题目内容
在密闭容器中进行反应X2(g)+3Y2(g)?2Z2(g),若X2、Y2、Z2的起始浓度分别为0?1mol/L、0?3mol/L、0?2mol/L,达到平衡时下列物质的浓度可能为( )
分析:化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答:解:A、X2的浓度增大,说明反应向逆反应方向进行建立平衡,若生成X20?1mol/L,则Y2、Z2的浓度浓度变化分别为
0.3mol/L、0.2mol/L,Y2、Z2不可能完全转化,故A错误;
B、Y2的浓度增减小,说明反应向正反应方向进行建立平衡,若Y2减小0?1mol/L,则X2的浓度浓度减小为0.03mol/L,生成
Z2为0.067,故B正确;
C、Z2的浓度为0?4mol/L,说明反应向正反应方向进行建立平衡,若生成Z20?2mol/L,则X2、Y2的浓度浓度变化分别为
0.1mol/L、0.3mol/L,X2、Y2不可能完全转化,故C错误;
D、Y2的浓度为0?6mol/L,说明反应向逆反应方向进行建立平衡,若生成Y20?3mol/L,则消耗Z2的浓度为0?2mol/L,Z2不可能完全转化,故D错误.
故选B.
0.3mol/L、0.2mol/L,Y2、Z2不可能完全转化,故A错误;
B、Y2的浓度增减小,说明反应向正反应方向进行建立平衡,若Y2减小0?1mol/L,则X2的浓度浓度减小为0.03mol/L,生成
Z2为0.067,故B正确;
C、Z2的浓度为0?4mol/L,说明反应向正反应方向进行建立平衡,若生成Z20?2mol/L,则X2、Y2的浓度浓度变化分别为
0.1mol/L、0.3mol/L,X2、Y2不可能完全转化,故C错误;
D、Y2的浓度为0?6mol/L,说明反应向逆反应方向进行建立平衡,若生成Y20?3mol/L,则消耗Z2的浓度为0?2mol/L,Z2不可能完全转化,故D错误.
故选B.
点评:本题考查了化学平衡的建立,难度不大,关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法.

练习册系列答案
相关题目
在密闭容器中进行反应:X2(g)+Y2(g)?2Z(g)已知X2、Y2、Z的起始浓度分别为0.1mol?L-1、0.3mol?L-1、0.2mol?L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A、Z为0.35mol?L-1 | B、Y2为0.45mol?L-1 | C、X2为0.2 mol?L-1 | D、Z为0.4mol?L-1 |
(双选).在密闭容器中进行反应X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol.L-1、0.3mol.L-1、0.2mol.L-1,在一定条件下当反应达到平衡时,各物质的浓度有可能是( )
| A、Z为0.3mol.L-1, | B、X2为0.2mol.L-1, | C、Y2为0.3mol.L-1, | D、Z为0.4mol.L-1, |
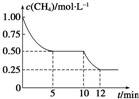 在密闭容器中进行反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)的变化如图所示.下列判断不正确的是( )
在密闭容器中进行反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)的变化如图所示.下列判断不正确的是( )| A、10min时,改变的外界条件可能是升高温度 | B、0~10min内,v(H2)=0.15mol?L-1?min-1 | C、恒温下,缩小容器体积,一段时间内v逆>v正 | D、12min时,反应达平衡的本质原因是气体总质量不再变化 |
 (2012?石家庄一模)常温下,A为无色无味液体,B为淡黄色粉末,D、E、G、W为气体,且G的相对分子质量比D大16,各物质间的转化关系如图所示:
(2012?石家庄一模)常温下,A为无色无味液体,B为淡黄色粉末,D、E、G、W为气体,且G的相对分子质量比D大16,各物质间的转化关系如图所示: