题目内容
 (2012?石家庄一模)常温下,A为无色无味液体,B为淡黄色粉末,D、E、G、W为气体,且G的相对分子质量比D大16,各物质间的转化关系如图所示:
(2012?石家庄一模)常温下,A为无色无味液体,B为淡黄色粉末,D、E、G、W为气体,且G的相对分子质量比D大16,各物质间的转化关系如图所示:请回答:
(1 )反应①的化学方程式为
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
(2)以D为燃气,E、G的混合气体为助燃气,熔融K2CO3为电解质的燃料电池中,负极的反应式为
CO+CO32--2e-=2CO2
CO+CO32--2e-=2CO2
(3)已知:D和W的燃烧热分别为-283.0kJ/mol,-285.8kJ/mol,1 mol A由液态变为气态时吸收热量44kJ,反应②的热化学方程式为
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2kJ/mol
.(4)将标准状况下4.48L G通入到100mL 3mol/L F溶液中,充分反应后,所得溶液中离子浓度由大到小的顺序为
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
(5)一定温度下,反应②的平衡常数为
| 9 |
| 4 |
| 物质 | A | D | G | W |
| 浓度/(mol?L-1) | 0.45 | 0.45 | 0.55 | 0.55 |
>
>
v逆(填“<“、“>”或“=”).②反应达到平衡时W的浓度c(W)=
0.6mol/L
0.6mol/L
.分析:A为无色无味液体,B为淡黄色粉末,淡黄色固体有Na2O2、硫单质、溴化银,A为H2O,A能和B反应生成气体,则B是Na2O2,E是O2,水和D在高温下反应生成气体W,能和水高温下反应生成两种气体的物质的气体是CO,D为CO,W能燃烧,所以G为CO,W是H2,F为NaOH,结合物质的性质分析解答.
解答:解:A为无色无味液体,B为淡黄色粉末,淡黄色固体有Na2O2、硫单质、溴化银,A为H2O,A能和B反应生成气体,则B是Na2O2,E是O2,水和D在高温下反应生成气体W,能和水高温下反应生成两种气体的物质的气体是CO,D为C,W能燃烧,所以G为CO,W是H2,F为NaOH,
(1)过氧化钠和水反应生成氢氧化钠和氧气,反应方程式为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(2)该燃料电池中,负极上燃料失电子发生氧化反应,所以负极上一氧化碳失电子和碳酸根离子反应生成二氧化碳,电极反应式为CO+CO32--2e-=2CO2 ,
故答案为:CO+CO32--2e-=2CO2;
(3)CO(g)+
O2(g)=CO2(g)△H=-283.0kJ/mol①,
H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol②,
H2O(l)=H2O(g)△H=+44kJ/mol③,
将①-②-③得CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2 kJ/mol
故答案为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2 kJ/mol;
(4)4.48L CO2通入到100mL 3mol/LNaOH溶液中,二氧化碳的物质的量=
=0.2mol,氢氧化钠的物质的量3mol/L×0.1L=0.3mol,
当1<n(NaOH):n(CO2)<2时,生成物是碳酸钠和碳酸氢钠,
根据二氧化碳和氢氧化钠物质的量之间的关系得方程式为2CO2+3NaOH=Na2CO3+NaHCO3+H2O,根据方程式知,碳酸钠和碳酸氢钠的物质的量相等,碳酸根离子和碳酸氢根离子水解而使溶液呈碱性,则c(OH-)>c(H+),碳酸根离子的水解能力大于碳酸氢根离子,所以c(HCO3-)>c(CO32-),钠离子不水解,离子浓度最大,所以离子浓度大小顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(5)①浓度商=
=1.49<
,所以平衡向正反应方向移动,则正反应速率大于逆反应速率,
故答案为:>;
②设平衡时W的浓度为x,平衡常数K=
=
,
=
,x=0.6mol/L,
故答案为:0.6 mol/L.
(1)过氧化钠和水反应生成氢氧化钠和氧气,反应方程式为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(2)该燃料电池中,负极上燃料失电子发生氧化反应,所以负极上一氧化碳失电子和碳酸根离子反应生成二氧化碳,电极反应式为CO+CO32--2e-=2CO2 ,
故答案为:CO+CO32--2e-=2CO2;
(3)CO(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
H2O(l)=H2O(g)△H=+44kJ/mol③,
将①-②-③得CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2 kJ/mol
故答案为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2 kJ/mol;
(4)4.48L CO2通入到100mL 3mol/LNaOH溶液中,二氧化碳的物质的量=
| 4.48L |
| 22.4L/mol |
当1<n(NaOH):n(CO2)<2时,生成物是碳酸钠和碳酸氢钠,
根据二氧化碳和氢氧化钠物质的量之间的关系得方程式为2CO2+3NaOH=Na2CO3+NaHCO3+H2O,根据方程式知,碳酸钠和碳酸氢钠的物质的量相等,碳酸根离子和碳酸氢根离子水解而使溶液呈碱性,则c(OH-)>c(H+),碳酸根离子的水解能力大于碳酸氢根离子,所以c(HCO3-)>c(CO32-),钠离子不水解,离子浓度最大,所以离子浓度大小顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(5)①浓度商=
| 0.55×0.55 |
| 0.45×0.45 |
| 9 |
| 4 |
故答案为:>;
②设平衡时W的浓度为x,平衡常数K=
| x×x |
| (0.45+0.55-x)2 |
| 9 |
| 4 |
| x |
| 1-x |
| 3 |
| 2 |
故答案为:0.6 mol/L.
点评:本题以无机推断为载体考查了化学平衡、盖斯定律、原电池原理等知识点,正确推断物质是解本题关键,结合化学平衡常数公式、物质的性质、盖斯定律等知识来分析解答,难点是离子浓度大小的比较,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
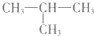 (2012?石家庄一模)2-甲基丙烷(如图)的二氯代物共有(不考虑立体异构)( )
(2012?石家庄一模)2-甲基丙烷(如图)的二氯代物共有(不考虑立体异构)( )