题目内容
8.2016年7月4日河南省召开了“防治大气污染攻坚战”动员大会,会上各级政府签订了保护大气环境目标责任书.下列有关活动或行为不符合这一主题的是( )| A. | 发展循坏经济,构建资源节约型社会及开发清洁生产技术 | |
| B. | 用绿色化学生产工艺,建立环境友好型化工体系 | |
| C. | 大力开发可再生资源,推广使用乙醇汽油代替传统的燃油 | |
| D. | 设计化学实验方案时,提倡用尽可能多的样品和试剂以提高实验效果 |
分析 A.发展循环经济,减少了污染物的排放;
B.采用“绿色化学”工艺,从根本上减少或杜绝污染;
C.化石燃料的燃烧产生大量空气污染物;
D.用尽可能多的样品和试剂以提高实验效果会造成大量空气污染物的产生.
解答 解:A.发展循环经济,构建资源节约型社会,有利于防止大气污染,符合题意,故A正确;
B.采用“绿色化学”工艺,从根本上减少或杜绝污染,有利于防止大气污染,符合题意,故B正确;
C.大力开发可再生资源,推广使用乙醇汽油代替传统的燃油,可以减少化石燃料燃烧产生的大量空气污染物,有利于防止空气污染,符合题意,故C正确;
D.用尽可能多的样品和试剂以提高实验效果会造成大量空气污染物的产生,不利于空气保护,不符合题意,故D错误;
故选:D.
点评 本题考查生活环境的污染和治理,新能源的使用,明确常见的生活环境污染与治理方法是解题关键,题目难度不大,注意知识的积累,注意养成节能减排,低碳生活的习惯.

练习册系列答案
相关题目
18.关于蛋白质的下列说法正确的是( )
| A. | 蛋白质在体内代谢的最终产物是硝酸 | |
| B. | 灼烧蛋白质没有明显现象 | |
| C. | 误食重金属盐会使人中毒,应立即喝牛奶、豆浆解毒 | |
| D. | 加热会使蛋白质变性,因此生吃鸡蛋比熟吃好 |
19.在一真空固定体积的密闭容器中,充入10mol N2和30mol H2混合后发生反应:N2+3H2?2NH3.在一定温度下达到平衡,H2的转化率为20%.若在同一容器中充入NH3,欲使反应达到平衡时各成分的百分含量与上述平衡时相同,则起始时充入NH3的物质的量和达到平衡时NH3的转化率是( )
| A. | 15mol 20% | B. | 20mol 20% | C. | 20mol 80% | D. | 40mol 80% |
3.下列关于氯气的叙述,不正确的是( )
| A. | 氯气是一种黄绿色的有毒气体 | |
| B. | 灼热的铜丝在氯气中燃烧,生成棕黄色的烟 | |
| C. | 可以用排饱和食盐水法收集氯气 | |
| D. | 氯水、液氯是同一种物质 |
13.向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起.上述实验过程中没有发生的离子反应是( )
| A. | Al3++4OH-→[Al(OH)4]- | B. | Al2O3+2OH-+3H2O=2[Al(OH)4]- | ||
| C. | CO2+2OH-=CO32-+H2O | D. | 2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ |
20.关于下列各装置图的叙述中,正确的是( )
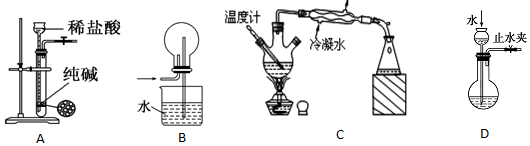

| A. | 用图A装置制取少量CO2气体 | |
| B. | 多余的NH3可用图B装置吸收 | |
| C. | 装置C可分离沸点不同且互溶的液体混合物 | |
| D. | 图D可检查装置的气密性 |
17.溶液、胶体、浊液三种分散系最本质的区别是( )
| A. | 稳定性 | B. | 透明度 | ||
| C. | 能否发生丁达尔现象 | D. | 分散质微粒大小 |
3.氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间隙法”制取,反应原理、实验装置图(加热装置都已略去)如下:
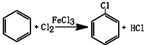
已知:氯苯为无色液体,沸点132.2℃.
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是平衡气压,冷凝管中冷水应从a(填“a”或“b”) 处通入.
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60℃为宜,温度过高会生成二氯苯.
①对C加热的方法是c(填序号)
a.酒精灯加热 b.油浴加热 c.水浴加热
②D出口的气体成分有HCl、苯蒸汽和氯气;
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本.写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl;HCl+NaOH=NaCl+H2O;(写两个即可)
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是五氧化二磷或氯化钙;
(5)工业生产中苯的流失情况如下:
则lt苯可制得成品为$\frac{(1-0.0892)×112.5}{78}$t(只要求列式).

已知:氯苯为无色液体,沸点132.2℃.
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是平衡气压,冷凝管中冷水应从a(填“a”或“b”) 处通入.
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60℃为宜,温度过高会生成二氯苯.
①对C加热的方法是c(填序号)
a.酒精灯加热 b.油浴加热 c.水浴加热
②D出口的气体成分有HCl、苯蒸汽和氯气;
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本.写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl;HCl+NaOH=NaCl+H2O;(写两个即可)
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是五氧化二磷或氯化钙;
(5)工业生产中苯的流失情况如下:
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
 )的官能团的名称为碳碳双键、羟基.
)的官能团的名称为碳碳双键、羟基.