题目内容
2.Na2O2做呼吸面具供氧剂,其所发生化学方程式为2Na2O2+2H2O=4NaOH+O2↑、2Na2O2+2CO2=2Na2CO3+O2在这个反应中电子转移总数为1被氧化的是-1价态的氧元素,氧化剂是Na2O2.分析 人呼出的气体中含有水蒸气和二氧化碳,Na2O2与二氧化碳反应生成碳酸钠和氧气(以此反应为主),Na2O2和水反应生成氢氧化钠和氧气,所以可以作供氧剂,Na2O2反应时,过氧化钠中O元素化合价由-1价变为0价、-2价,元素化合价升高的反应物为还原剂,被氧化,元素化合价降低的反应物为氧化剂,被还原,据此分析解答.
解答 解:人呼出的气体中含有水蒸气和二氧化碳,Na2O2能和水、二氧化碳反应生成钠的化合物和氧气,反应方程式为2Na2O2+2H2O=4NaOH+O2↑、2Na2O2+2CO2=2Na2CO3+O2,所以可以作供氧剂,
Na2O2反应时,过氧化钠中O元素化合价由-1价变为0价、-2价,这两个反应2Na2O2+2H2O=4NaOH+O2↑、2Na2O2+2CO2=2Na2CO3+O2中参加反应的过氧化钠有一半的作氧化剂、一半的作还原剂,所以在上述反应中电子转移总数转移电子物质的量=$\frac{1}{2}$×2×[0-(-1)]=1,被氧化的是-1价态的氧元素,氧化剂是Na2O2,
故答案为:2Na2O2+2H2O=4NaOH+O2↑、2Na2O2+2CO2=2Na2CO3+O2;1;-1;Na2O2.
点评 本题以过氧化钠为载体考查物质之间的反应、氧化还原有关知识,明确物质的性质是解本题关键,注意该反应中过氧化钠中O元素化合价变化,题目难度不大.

练习册系列答案
相关题目
12.下列叙述正确的是( )
| A. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 | |
| B. | 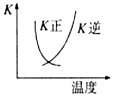 2SO2(g)+O2(g)?2SO3(g)△H<0的正、逆反应的平衡常数K随温度的变化可用图表示 | |
| C. | 2NO+2CO?2CO2+N2 △H<0,常温下该反应一定能自发进行 | |
| D. | FeCl3溶液和Fe2(SO4)3溶液加热蒸干.灼烧都得到Fe2O3 |
13.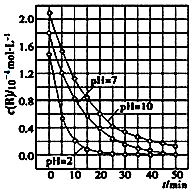 二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害.某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示.下列判断正确的是( )
二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害.某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示.下列判断正确的是( )
 二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害.某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示.下列判断正确的是( )
二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害.某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示.下列判断正确的是( )| A. | 在0~50 min之间,R的降解百分率pH=2大于pH=7 | |
| B. | 溶液酸性越强,R的降解速率越大 | |
| C. | R的起始浓度不同,无法判断溶液的酸碱性对R的降解速率的影响 | |
| D. | 在20~25 min之间,pH=10时R的降解速率为04mol•L-1•min-1 |
7.下列图中所示的实验操作评价合理的是( )
| A. | 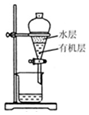 用如图装置分离有机 层与水层,水层从分液 漏斗下口放出 | |
| B. | 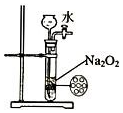 用如图装置可用来制 备少量氧气,并且控制 反应的发生与停止 | |
| C. | 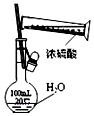 如图中配制一定物质的量浓度的硫酸溶液不能 直接在容量瓶中进行 | |
| D. | 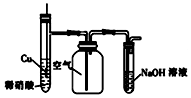 用如图装置制备并收集NO气体 |
14.称取两份铝粉,第一份加入足量的浓氢氧化钠溶液,第二份加入足量的稀盐酸,如果要放出等体积的气体(在同温同压下),两份铝的质量之比为( )
| A. | 1:2 | B. | 1:3 | C. | 3:2 | D. | 1:1 |
20.下列曲线图(纵坐标为沉淀的物质的量,横坐标为加入物的量)不正确的是( )
| A. | 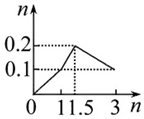 向1 L浓度均为0.1 mol•L-1的Ba(OH)2、NaAlO2混合液中加入0.1 mol•L-1稀硫酸 | |
| B. |  向1 L含有0.1 mol•L-1 AlCl3和0.3 mol•L-1 NH4Cl的混合液中加入0.1 mol•L-1 NaOH溶液 | |
| C. |  向烧碱溶液滴加明矾溶液 | |
| D. | 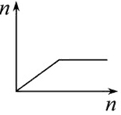 向AlCl3溶液滴加过量氨水 |
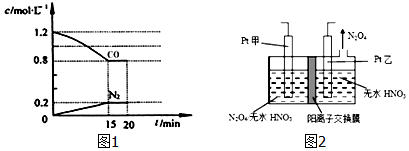
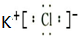 ;
; .
.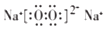 (用电子式表示).
(用电子式表示).