题目内容
下列关于O2+2SO2?2SO3的叙述错误的是( )
分析:增大反应物的浓度、升高温度、使用催化剂均能增大化学反应速率,但可逆反应中反应物不能完全转化,以此来解答.
解答:解:A.增加O2的浓度,活化分子的数目增多,能加快反应速率,故A正确;
B.该反应为可逆反应,所以O2足量,也不能使SO2完全转化为SO3,故B错误;
C.加入催化剂,活化分子的百分数增多,能加快反应速率,故C正确;
D.升高体系温度,活化分子的百分数增多,能加快反应速率,故D正确;
故选B.
B.该反应为可逆反应,所以O2足量,也不能使SO2完全转化为SO3,故B错误;
C.加入催化剂,活化分子的百分数增多,能加快反应速率,故C正确;
D.升高体系温度,活化分子的百分数增多,能加快反应速率,故D正确;
故选B.
点评:本题考查影响化学反应速率的因素,明确温度、浓度、催化剂对反应速率的影响即可解答,注意可逆反应的特点,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
(12分)工业制硫酸时,利用接触氧化反应将SO2转化为SO3是一个关键的步骤。
(1)在接触室中2SO2(g)+O2(g)
 2SO3(g)达到平衡状态的标志是______。
2SO3(g)达到平衡状态的标志是______。
A.υ(O2)正=2υ(SO2)逆
B.容器中气体的总质量不随时间而变化
C.容器中气体的颜色不随时间而变化
D.容器中气体的压强不随时间而变化
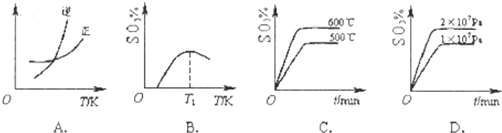
(2)下列关于反应2SO2(g)+O2(g)
 2SO3(g)
ΔH<0。下列图像中不正确的是______ (填字母序号)。
2SO3(g)
ΔH<0。下列图像中不正确的是______ (填字母序号)。

(3)某温度下SO2(g)+ 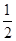 O2(g)
O2(g)
 SO3(g)
ΔH=-98KJ/mol
SO3(g)
ΔH=-98KJ/mol
①开始时在体积固定的密闭容器中加入4mol SO2 (g)和1mol O2 (g),达到平衡时 共放出196 KJ的热量,该温度下SO2的平衡转化率为______
②已知固态单质硫的燃烧热为296KJ/mol,则由S(s)生成2 molSO3(g)的ΔH为____________
(4)检验SO42-常用BaCl2溶液。常温时,BaSO4的Ksp=1.08×10-10,现将等体积的 BaCl2溶液与2.0×10-3mol/L的H2SO4溶液混合。若要生成BaSO4沉淀,原BaCl2溶液的最小浓度为____________