题目内容
工业制硫酸时,利用接触氧化反应将SO2转化为SO3是一个关键的步骤.
(1)在接触室中2SO2(g)+O2(g)?2SO3(g)达到平衡状态的标志是 .
A.v(O2)正=2v(SO2)逆
B.容器中气体的总质量不随时间而变化
C.容器中气体的颜色不随时间而变化
D.容器中气体的压强不随时间而变化
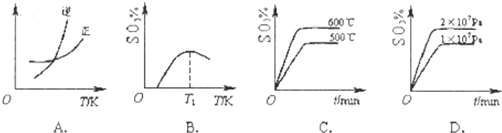
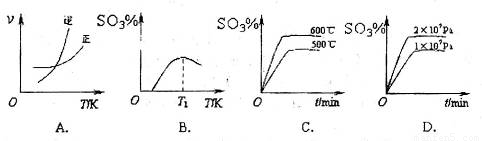
(2)下列关于反应2SO2(g)+O2(g)?2SO3(g)△H<0.下列图象中不正确的是 (填字母序号).
(3)某温度下SO2(g)+
O2(g)?SO3(g)△H=-98kJ.mol-1
①开始时在体积固定的密闭容器中加入4mol SO2 (g)和H) mol O2 (g),达到平衡时 共放出196KJ的热量,该温度下SO2的平衡转化率为
②已知固态单质硫的燃烧热为296kJ.mol-1,则由S(s)生成2molS03(g)的△H为
(4)检验SO
常用BaCl2溶液.常温时,BaSO4的Ksp=1.08×10-10,现将等体积的 BaCl2溶液与2.0×10-3mol/L的H2SO4溶液混合.若要生成BaSO4沉淀,原BaCl2溶液的最小浓度为 .
(1)在接触室中2SO2(g)+O2(g)?2SO3(g)达到平衡状态的标志是
A.v(O2)正=2v(SO2)逆
B.容器中气体的总质量不随时间而变化
C.容器中气体的颜色不随时间而变化
D.容器中气体的压强不随时间而变化
(2)下列关于反应2SO2(g)+O2(g)?2SO3(g)△H<0.下列图象中不正确的是

(3)某温度下SO2(g)+
| 1 |
| 2 |
①开始时在体积固定的密闭容器中加入4mol SO2 (g)和H) mol O2 (g),达到平衡时 共放出196KJ的热量,该温度下SO2的平衡转化率为
②已知固态单质硫的燃烧热为296kJ.mol-1,则由S(s)生成2molS03(g)的△H为
(4)检验SO
2- 4 |
分析:(1)A、不同物质的正逆反应速率之比等于计量数比之比,即是平衡状态,;
B、容器中气体的总质量守恒始终不变;
C、容器中气体均为无色;
D、反应两边气体的计量数之和不相等,体积恒定的密闭容器中,达到了平衡状态,压强不再变化;
(2)已知2SO2(g)+O2(g)?2SO3(g)△H<0,该反应正方向为:体积减小,放热反应;结合温度、压强对速率和平衡的影响分析;
(3)先根据放出的热量计算出n(SO2),再根据转化率公式求出SO2的转化率;
(4)依据燃烧热概念写出热化学方程式,硫燃烧生成稳定氧化物二氧化硫;再根据二氧化硫催化氧化为三氧化硫的热化学方程式,结合盖斯定律计算得到;
(5)计算混合后硫酸根的浓度,根据Ksp(BaSO4)=c(Ba2+)?c(SO42-)计算硫酸根沉淀时溶液中c(Ba2+),原氯化钡溶液为此时钡离子浓度的2倍,注意溶液混合后各种物质的浓度降为原来的一半.
B、容器中气体的总质量守恒始终不变;
C、容器中气体均为无色;
D、反应两边气体的计量数之和不相等,体积恒定的密闭容器中,达到了平衡状态,压强不再变化;
(2)已知2SO2(g)+O2(g)?2SO3(g)△H<0,该反应正方向为:体积减小,放热反应;结合温度、压强对速率和平衡的影响分析;
(3)先根据放出的热量计算出n(SO2),再根据转化率公式求出SO2的转化率;
(4)依据燃烧热概念写出热化学方程式,硫燃烧生成稳定氧化物二氧化硫;再根据二氧化硫催化氧化为三氧化硫的热化学方程式,结合盖斯定律计算得到;
(5)计算混合后硫酸根的浓度,根据Ksp(BaSO4)=c(Ba2+)?c(SO42-)计算硫酸根沉淀时溶液中c(Ba2+),原氯化钡溶液为此时钡离子浓度的2倍,注意溶液混合后各种物质的浓度降为原来的一半.
解答:解:(1)A、不同物质的正逆反应速率之比等于计量数比之,即是平衡状态,所以2v(O2)正=v(SO2)逆,证明达到了平衡状态,故A错误;
B、容器中气体的总质量守恒始终不变,所以质量不变,不能判断平衡状态,故B错误;
C、容器中气体均为无色,所以气体的颜色始终不变,不能判断平衡状态,故C错误;
D、反应两边气体的计量数之和不相等,体积恒定的密闭容器中,达到了平衡状态,压强不再变化,证明达到了平衡状态,故D正确;
故答案为:D;
(2)已知2SO2(g)+O2(g)?2SO3(g)△H<0,该反应正方向为:体积减小,放热反应;
A、升高温度平衡逆移,所以逆速率大于正速率,与图象相符,故A正确;
B、随着反应进行三氧化硫的含量逐渐增大,当达到平衡时,再升高温度,平衡逆移,所以三氧化硫含量减小,与图象相符,故B正确;
C、升高温度,平衡逆移,所以三氧化硫含量减小,温度高反应速率快,达到平衡所需时间短,所以600℃的曲线应该在下面,故C错误;
D、该反应正方向为:体积减小的方向,增大压强,平衡正移,三氧化硫的含量增大,所以压强大的曲线在上面,故D正确;
故答案为:C;
(3)在T2温度时,开始在100L的密闭容器中加入4.0molSO2和10.0molO2,一定条件下当反应达到平衡时共放出热量196kJ根据1molSO2完全反应放热98KJ;则一定条件下当反应达到平衡时共放出热量196kJ,消耗二氧化硫物质的量=
=2mol,
SO2(g)+
O2(g)?SO3(g)
开始量(mol) 4 10 0
变化量(mol) 2 1 2
平衡量(mol) 2 9 2
所以SO2的转化率α=
×100%=50%,故答案为:50%;
(4)已知单质硫的燃烧热为296kJ/mol,是1mol硫完全燃烧生成稳定氧化物二氧化硫时放出的热量,则硫燃烧的热化学方程式为:①S(s)+O2(g)=SO2(g)△H=-296 kJ/mol;
二氧化硫催化氧化为二氧化硫的热化学方程式为:②2SO2(g)+O2(g)?2SO3(g)△H=-196KJ/L;
依据盖斯定律计算得到①×2+②:2S(s)+3O2(g)=2SO3(g),△H=[-296×2+(-196)]=-788KJ/mol;
所以2mol S(s)生成2mol SO3(g)的焓变=-788KJ/mol;
故答案为:-788KJ/mol;
(5)等体积混合后,c(SO42-)=
×2.0×10-3mol/L=1.0×10-3mol/L,故BaSO4沉淀所需Ba2+离子的最小浓度为c(Ba2+)=
mol/L=1.08×10-7mol/L,故原BaCl2溶液的浓度为2×1.08×10-7mol/L=2.16×10-7mol/L,故答案为:2.16×10-7mol/L.
B、容器中气体的总质量守恒始终不变,所以质量不变,不能判断平衡状态,故B错误;
C、容器中气体均为无色,所以气体的颜色始终不变,不能判断平衡状态,故C错误;
D、反应两边气体的计量数之和不相等,体积恒定的密闭容器中,达到了平衡状态,压强不再变化,证明达到了平衡状态,故D正确;
故答案为:D;
(2)已知2SO2(g)+O2(g)?2SO3(g)△H<0,该反应正方向为:体积减小,放热反应;
A、升高温度平衡逆移,所以逆速率大于正速率,与图象相符,故A正确;
B、随着反应进行三氧化硫的含量逐渐增大,当达到平衡时,再升高温度,平衡逆移,所以三氧化硫含量减小,与图象相符,故B正确;
C、升高温度,平衡逆移,所以三氧化硫含量减小,温度高反应速率快,达到平衡所需时间短,所以600℃的曲线应该在下面,故C错误;
D、该反应正方向为:体积减小的方向,增大压强,平衡正移,三氧化硫的含量增大,所以压强大的曲线在上面,故D正确;
故答案为:C;
(3)在T2温度时,开始在100L的密闭容器中加入4.0molSO2和10.0molO2,一定条件下当反应达到平衡时共放出热量196kJ根据1molSO2完全反应放热98KJ;则一定条件下当反应达到平衡时共放出热量196kJ,消耗二氧化硫物质的量=
| 1mol×196KJ |
| 98KJ |
SO2(g)+
| 1 |
| 2 |
开始量(mol) 4 10 0
变化量(mol) 2 1 2
平衡量(mol) 2 9 2
所以SO2的转化率α=
| 2mol |
| 4mol |
(4)已知单质硫的燃烧热为296kJ/mol,是1mol硫完全燃烧生成稳定氧化物二氧化硫时放出的热量,则硫燃烧的热化学方程式为:①S(s)+O2(g)=SO2(g)△H=-296 kJ/mol;
二氧化硫催化氧化为二氧化硫的热化学方程式为:②2SO2(g)+O2(g)?2SO3(g)△H=-196KJ/L;
依据盖斯定律计算得到①×2+②:2S(s)+3O2(g)=2SO3(g),△H=[-296×2+(-196)]=-788KJ/mol;
所以2mol S(s)生成2mol SO3(g)的焓变=-788KJ/mol;
故答案为:-788KJ/mol;
(5)等体积混合后,c(SO42-)=
| 1 |
| 2 |
| 1.08×10-10 |
| 10-3 |
点评:本题考查了平衡状态的判断、盖斯定律的应用、溶度积常数的有关计算等知识点,难度较大.

练习册系列答案
相关题目
(12分)工业制硫酸时,利用接触氧化反应将SO2转化为SO3是一个关键的步骤。
(1)在接触室中2SO2(g)+O2(g)
 2SO3(g)达到平衡状态的标志是______。
2SO3(g)达到平衡状态的标志是______。
A.υ(O2)正=2υ(SO2)逆
B.容器中气体的总质量不随时间而变化
C.容器中气体的颜色不随时间而变化
D.容器中气体的压强不随时间而变化
(2)下列关于反应2SO2(g)+O2(g)
 2SO3(g)
ΔH<0。下列图像中不正确的是______ (填字母序号)。
2SO3(g)
ΔH<0。下列图像中不正确的是______ (填字母序号)。

(3)某温度下SO2(g)+  O2(g)
O2(g)
 SO3(g)
ΔH=-98KJ/mol
SO3(g)
ΔH=-98KJ/mol
①开始时在体积固定的密闭容器中加入4mol SO2 (g)和1mol O2 (g),达到平衡时 共放出196 KJ的热量,该温度下SO2的平衡转化率为______
②已知固态单质硫的燃烧热为296KJ/mol,则由S(s)生成2 molSO3(g)的ΔH为____________
(4)检验SO42-常用BaCl2溶液。常温时,BaSO4的Ksp=1.08×10-10,现将等体积的 BaCl2溶液与2.0×10-3mol/L的H2SO4溶液混合。若要生成BaSO4沉淀,原BaCl2溶液的最小浓度为____________

 2SO3(g) △H=-197 kj/mol。开始时在10 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K= ,升高温度K将 (填“增大、减小或不变”)。
2SO3(g) △H=-197 kj/mol。开始时在10 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K= ,升高温度K将 (填“增大、减小或不变”)。 2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 (填字母)。
2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 (填字母)。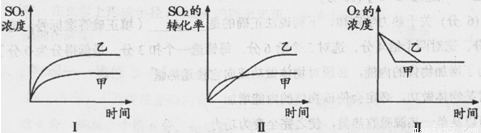
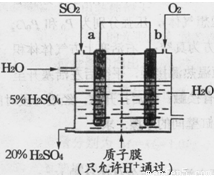
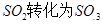 是一个关键的步骤。
是一个关键的步骤。 。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。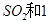 mol
mol ,发生反应:
,发生反应: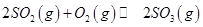 ,达平衡后改变下述条件,
,达平衡后改变下述条件,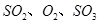 气体平衡浓度都比原来增大的是____________(填字母)。
气体平衡浓度都比原来增大的是____________(填字母)。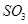
 的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH=__________
(忽略溶液体积变化)。
的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH=__________
(忽略溶液体积变化)。