题目内容
7.现有含少量CaCl2、MgSO4的粗食盐水,用①盐酸 ②Na2CO3 ③NaOH三种试剂除去食盐水中的Ca2+、Mg2+、SO42-.提纯的操作流程示意图如图所示:
图中b、c、d分别表示上述①-③三种试剂中的一种,请回答下列问题:
(1)沉淀A的化学式为BaSO4;
(2)试剂d是盐酸;判断试剂d已经足量的方法是取反应后的上层清液于试管中,继续滴加盐酸,无气泡生成,则说明盐酸已过量;
(3)加人b、c后溶液中发生反应的化学方程式分别为MgCl2+2NaOH=Mg(OH)2↓+2NaCl、CaCl2+Na2CO3=CaCO3↓+2NaCl、BaCl2+Na2CO3=BaCO3↓+2NaCl.
分析 由于粗食盐水中含Ca2+、Mg2+、SO42-,故当加入稍过量的BaCl2溶液时,生成的沉淀A为BaSO4,在滤液中仍有Ca2+、Mg2+、Ba2+等杂质离子,由于Mg(OH)2为沉淀,故除去Mg2+用NaOH溶液,除去Ca2+和Ba2+用Na2CO3溶液,据此分析所得的沉淀B和C的成分;滤液中仍有过量的OH-和CO32-,应加过量的HCl除去,据此分析气体D的成分.
解答 解:由于粗食盐水中含Ca2+、Mg2+、SO42-,故当加入稍过量的BaCl2溶液时,生成的沉淀A为BaSO4,在滤液中仍有Ca2+、Mg2+、Ba2+等杂质离子,由于Mg(OH)2为沉淀,故除去Mg2+用NaOH溶液,由于CaCO3和BaCO3为沉淀,故除去Ca2+和Ba2+用Na2CO3溶液,则所得的沉淀B和C分别为Mg(OH)2、CaCO3和BaCO3;所得的滤液中仍有过量的OH-和CO32-,应加过量的HCl除去,即试剂d为HCl,故所得的气体D为CO2.
(1)生成的沉淀A为BaSO4,故答案为:BaSO4;
(2)试剂d为HCl,当盐酸过量时,取反应后的上层清液于试管中,继续滴加盐酸,无气泡生成,则说明盐酸已过量,故答案为:盐酸;取反应后的上层清液于试管中,继续滴加盐酸,无气泡生成,则说明盐酸已过量;
(3)加入的b和c 为NaOH溶液和Na2CO3溶液,目的是除去Mg2+、Ca2+和过量的Ba2+,故化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;CaCl2+Na2CO3=CaCO3↓+2NaCl;BaCl2+Na2CO3=BaCO3↓+2NaCl,故答案为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;CaCl2+Na2CO3=CaCO3↓+2NaCl、BaCl2+Na2CO3=BaCO3↓+2NaCl.
点评 本题考查了粗盐提纯过程中试剂的加入顺序和所发生的反应,难度不大,注意从整体上把握试剂的加入顺序.

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案| A. | 常温下向10mlPH=12的NaOH溶液中加入PH=2的HA至PH=7所得的溶液的总体积V≧20ml | |
| B. | 在做中和滴定实验时向滴有酚酞的NaOH溶液中滴加盐酸至溶液恰好无色,此时溶液PH<7 | |
| C. | 肥田粉溶于水所得溶液中C(NH4+)>C(SO42-)>C(H+)>C(OH-) | |
| D. | PH>7的草酸钾溶液中C(OH-)-C(H+)=4 C(H2C2O4)+2 C(HC2O4-)+2 C(C2O42-)-C(K+) |
| A. | 0.5mol | B. | 1mol | C. | 1.5mol | D. | 2mol |
 已知某可逆反应:mA(气)+nB(气)?xC(气)△H=QkJ•mol-1,在密闭容器中进行,如图表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )
已知某可逆反应:mA(气)+nB(气)?xC(气)△H=QkJ•mol-1,在密闭容器中进行,如图表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )| A. | T1>T2,P1>P2,m+n>x,Q>0 | B. | T1>T2,P1<P2,m+n<x,Q<0 | ||
| C. | T1>T2,P1<P2,m+n<x,Q>0 | D. | T1<T2,P1>P2,m+n>x,Q<0 |



 →
→ .
.
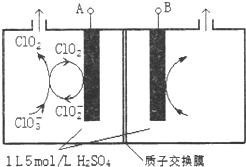 二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.