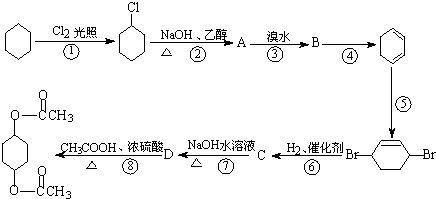
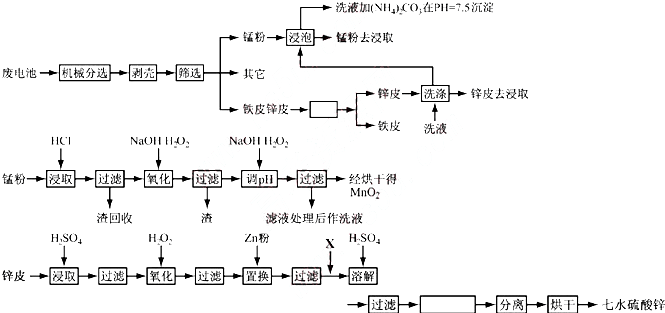
题目内容
现有下列微粒:H+、HCl、Mg、S2-、Cl2、I-、HClO.
(1)在化学反应中,只能失去电子的是 ;只能获得电子的有 .
(2)既能失去电子又能获得电子的是 .任选其中一种微粒举例说明(用化学方程式表示) .
(1)在化学反应中,只能失去电子的是
(2)既能失去电子又能获得电子的是
考点:氧化还原反应
专题:
分析:处于元素中间价的微粒既能失去电子又能获得电子,处于元素最高价的微粒只能得到电子,处于元素最低价的微粒只能失去电子,以此来解答.
解答:
解:(1)Mg、S2-、I-中元素的化合价均为最低价,只能失去电子,而H+中元素的化合价为最高价,只能得到电子,故答案为:Mg、S2-、I-;H+;
(2)HCl、Cl2、HClO既能失去电子又能获得电子,如2HClO
2HCl+O2↑,故答案为:HCl、Cl2、HClO;2HClO
2HCl+O2↑.
(2)HCl、Cl2、HClO既能失去电子又能获得电子,如2HClO
| ||
| ||
点评:本题考查氧化还原反应,为高频考点,把握微粒的性质与元素化合价的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
关于Na2O2与CO2、H2O反应的叙述正确的是( )
| A、Na2O2与CO2反应中,Na2O2只作还原剂,CO2作氧化剂 |
| B、Na2O2与H2O反应中,Na2O2既作氧化剂又做还原剂 |
| C、Na2O2与CO2反应中,1mol Na2O2转移2mol电子 |
| D、Na2O2与水反应中,1mol Na2O2转移1mol电子 |
下列化学键的极性最强的是( )
| A、C-H | B、C-O |
| C、C-N | D、O-H |
将CO2气体缓缓地通入到含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示.下列关于整个反应进程中的各种描述不正确的是( )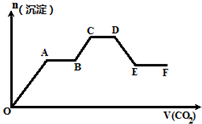

| A、O~A段反应的化学方程式是Ba(OH)2+CO2═BaCO3↓+H2O |
| B、A~B段反应的离子方程式是2OH-+CO2═CO32-+H2O |
| C、A~B段与C~D段所发生的反应相同 |
| D、D~E段沉淀的减少是由于碳酸钡固体的溶解所致 |