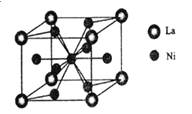
题目内容
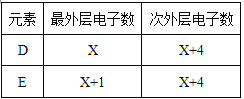
【题目】今有原子序数依次增大的A、B、C、D、E、F六种元素。已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间,两两皆能反应且均能生成盐和水。D和E各有如下表的电子层结构。
按要求填空:
(1)A的元素符号 ,质子数比中子数少2的B元素的一种核素的符号 ,F的原子结构示意图 。
(2)D和E两者的氢化物稳定性较强的是 (填化学式)。
(3)C单质与A元素的最高价氧化物对应的水化物反应的离子方程式为 。
(4)工业上制取单质D的化学方程式为 。
【答案】(1)Na;![]() ;
; ;
;
(2) PH3;(3) 2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4) SiO2+2C![]() 2CO↑+Si。
2CO↑+Si。
【解析】试题分析:A、B、C、D、E、F为原子序数依次增大的短周期主族元素,A、C、F三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,C是Al元素,Al最外层有3个电子,那么A和F的最外层电子数为8,据此得出A应是金属性很强的元素且原子序数小于Al,则A是Na元素,F是Cl元素,B的原子序数大于A而小于C,所以B是Mg元素;D元素原子的最外层电子数比次外层少4个,最外层是8个电子,则其最外层是4个电子,所以D是Si元素;E元素原子次外层电子数比最外层多3个,次外层是8个电子,则最外层是5个电子,所以E是P元素。依据分析可知:A为钠、B为镁、C为铝、D为硅、E为磷、F为氯。
(1)A为Na,B是12号Mg元素,质子数比中子数少2的B元素的一种核素质量数是12+(12+2)=26,该原子的符号表示为![]() ;F为氯,F的原子结构示意图是
;F为氯,F的原子结构示意图是 ;
;
(2)D为硅、E为磷,由于元素的非金属性P>Si,元素的非金属性越强,其氢化物稳定性就越强。所以稳定性:PH3>SiH4;
(3)Al单质与A的最高价氧化物的水化物氢氧化钠溶液发生反应,产生偏铝酸钠和氢气,反应的离子方程式是:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)D为硅,在工业上是用焦炭还原SiO2制取Si的,反应的化学方程式是:SiO2+2C![]() 2CO↑+Si。
2CO↑+Si。