题目内容
【题目】镍(28Ni)金属羰基化合物[金属元素和一氧化碳(CO)中性分子形成的一类配合物]、金属储氢材料[能可逆的多次吸收、储存和释放氢气(H2)的合金]等领域用途广泛。
(1)Ni原子基态核外电子排布式为_________________。
(2)Ni(CO)4中镍的化合价为_____________,写出与CO互为等电子体的中性分子、带一个单位正电荷的阳离子、带一个单位负电荷的阴离子各一个:__________、_____________、___________。
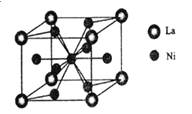
(3)一种储氢合金由镍与镧(La)组成,其晶胞结构如图所示.则该晶体的化学式为_________。
(4)下列反应常用来检验Ni2+,请写出另一产物的化学式__________。
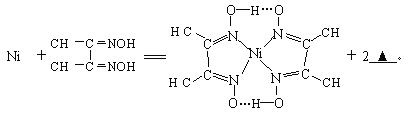
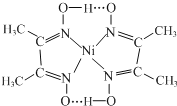
与Ni2+配位的N原子有_________个,该配合物中存在的化学键有__________(填序号)。
A共价键 B离子键 C配位键 D金属键 E氢键
【答案】(1)[Ar]3d84s2 (2)0 N2、NO+、CN-(3)LaNi5(4)H+ 4 ACE
【解析】
试题分析:(1)Ni的原子序数为28,根据构造原理可写出电子排布式为:1s22s22p63s23p63d84s2或[Ar]3d84s2;
因此,本题正确答案是:1s22s22p63s23p63d84s2或[Ar]3d84s2;
(2)CO为分子,化合价为0,所以镍的化合价为0;CO含有2个原子14个电子,所以CO互为等电子体的中性分子、带一个单位正电荷阳离子、带一个单位负电荷阴离子分别为:N2、NO+、CN-;因此,本题正确答案是:0;N2;NO+;CN-;
(3)该晶胞中La原子个数=8×1/8=1,Ni原子个数=1+8×1/2=5,化学式为LaNi5(或Ni5La),因此,本题正确答案是:LaNi5(或Ni5La);
(4)由质量守恒与电荷守恒可以知道,Ni2+![]() ═
═ +2H+;
+2H+;
Ni含有空轨道、N原子含有孤电子对,所以配位键由N原子指向Ni原子,有4个配位键;该配合物中N-O中O原子和-OH中氢原子形成氢键,该配合物分子中配位键、氢键为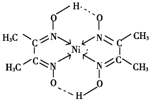 ,除此之外还含有共价键;因此,本题正确答案是:H+;4;ACE.
,除此之外还含有共价键;因此,本题正确答案是:H+;4;ACE.

【题目】用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:

已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
2Fe3++ FeS2=2S↓+3Fe2+
(1)“还原”时,pH不宜过高的原因是____________,写出“还原”时反应Ⅱ的离子方程式:___________。
(2)实验测得“还原”时反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为2:7。计算“还原”后溶液Fe2+的浓度即可确定后面所加(NH4)2SO4的量(溶液体积变化忽略不计)。
离子 | 离子浓度(mol·L-1) | |
还原前 | 还原后 | |
SO42- | 3.2 | 3.5 |
Fe2+ | 0.15 | |
(3)称取23.52g新制莫尔盐,溶于水配成溶液并分成两等份。一份加入足量的BaCl2溶液,得到白色沉淀13.98g;另一份用0.2000mol/LK2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗溶液的体积为25.00mL。试确定莫尔盐的化学式__________。