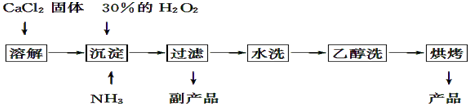
题目内容
4.NA表示阿伏加德罗常数,下列叙述不正确的是( )| A. | 在7.8gNa2O2晶体中阳离子与阴离子总数为0.3NA | |
| B. | 在KIO3+6HI=KI+3I2+3H2O反应中,每生成3mol I2,则转移6NA个电子 | |
| C. | 1mol Na2O2与H2O完全反应,转移的电子总数为NA | |
| D. | 在1L0.1mol/L的碳酸钠溶液中,阴离子总数大于0.1NA |
分析 A.1mol过氧化钠中含2mol钠离子和1mol阴离子;
B.生成3mol碘单质转移了5mol电子;
C.每有1molNa2O2生成,电子转移1mol;
D.碳酸钠溶液中,碳酸根离子部分水解生成碳酸氢根离子和氢氧根离子,导致阴离子数目增多.
解答 解:A.7.8gNa2O2的物质的量为0.1mol,离子总数为0.3NA,故A正确;
B.在反应KIO3+6HI═KI+3I2+3H2O中,碘酸钾中碘离子被还原生成碘单质,每生成3mol I2转移5mol电子,转移的电子数为5NA,故B错误;
C.该反应中每有1molNa2O2生成,电子转移1mol,电子总数为NA,故C正确;
D.1L 0.1mol/L的碳酸钠溶液中含有溶质碳酸钠0.1mol,由于碳酸根离子水解,导致阴离子数目增多,所以溶液中含有的阴离子的物质的量大于0.1mol,阴离子总数大于0.1NA,故D正确.
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
14.下列各组仪器常用于物质分离的是( )


| A. | ①③⑥ | B. | ②④⑥ | C. | ②③⑥ | D. | ②③⑤ |
9.设NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 1mol NH4+ 含有的电子总数为10NA | |
| B. | 1mol Mg 与足量盐酸反应时失去NA个电子 | |
| C. | 28g N2 所含原子数目为NA | |
| D. | 在101KPa、25℃条件下,11.2L H2 中含有的原子数目为NA |
16.下列溶液中,跟100mL 0.8mol•L-1NaCl溶液所含的Cl-物质的量浓度相同的是( )
| A. | 100 mL 0.8 mol•L-1MgCl2溶液 | B. | 200 mL 0.4 mol•L-1AlCl3溶液 | ||
| C. | 50 mL 1.6 mol•L-1NaCl溶液 | D. | 25 mL 0.8 mol•L-1HCl溶液 |
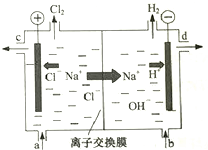 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:

 .
.
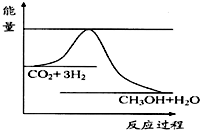 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.