题目内容
物质N2O4在一定条件下的定容密闭容器中发生如下反应:N2O4(g)?2NO2(g)
(1)当N2O4的起始浓度为0.50mol?L-1时,实验测得某温度时的平衡转化率(α)是10%.列式计算该温度时上述反应的平衡常数K= (结果保留两位有效数字).向容器中增加NO2的量,K值 .
(2)一定温度下,随着N2O4的起始浓度增大,其平衡转化率 (填“增大”、“不变”或“减小”).下列能够说明上述反应已经达到平衡状态的是 .(填写字母)
A.混合气体的颜色不在发生变化 B.N2O4和NO2的分子数之比为1:1
C.混合气体的平均摩尔质量不在发生变化 D.混合气体的质量不在发生变化
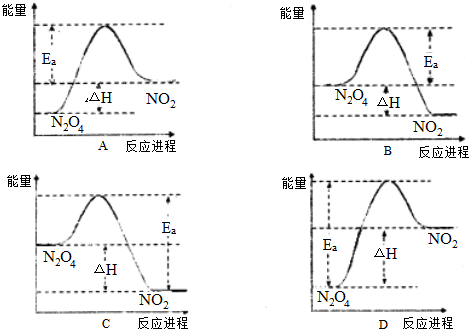
(3)实验测得该反应的△H=akJ?mol-1,Ea=bkJ?mol-1,下列能量关系图合理的是 .
(4)该反应的△S 0(填“>”、“<”或“=”),在 (填“较高”或“较低”)温度下有利于该反应自发进行.
(1)当N2O4的起始浓度为0.50mol?L-1时,实验测得某温度时的平衡转化率(α)是10%.列式计算该温度时上述反应的平衡常数K=
(2)一定温度下,随着N2O4的起始浓度增大,其平衡转化率
A.混合气体的颜色不在发生变化 B.N2O4和NO2的分子数之比为1:1
C.混合气体的平均摩尔质量不在发生变化 D.混合气体的质量不在发生变化
(3)实验测得该反应的△H=akJ?mol-1,Ea=bkJ?mol-1,下列能量关系图合理的是

(4)该反应的△S
考点:化学平衡的影响因素,热化学方程式,化学平衡状态的判断
专题:化学平衡专题
分析:(1)根据反应方程式及四氧化二氮的转化率计算出达到平衡时二氧化氮、四氧化二氮的浓度,再根据平衡常数表达式计算出该温度下该反应的平衡常数;温度不变,平衡常数不变;
(2)该反应为体积增大的反应,增大四氧化二氮浓度,相当于压强,平衡向着逆向移动;可逆反应达到平衡状态时,正逆反应速率相等,各组分的浓度不再变化,据此对各选项进行判断;
(3)反应N2O4(g)?2NO2(g)为吸热反应,△H=akJ?mol-1,则生成物的总能量高akJ;活化能Ea=bkJ?mol-1,则反应物分子变为活化分子的能量为bkJ?mol-1,以此来解答.
(4)根据反应方程式判断熵变;△G=△H-T?△S进行判断,如△G<0,则反应能自发进行,如△G>0,则不能自发进行.
(2)该反应为体积增大的反应,增大四氧化二氮浓度,相当于压强,平衡向着逆向移动;可逆反应达到平衡状态时,正逆反应速率相等,各组分的浓度不再变化,据此对各选项进行判断;
(3)反应N2O4(g)?2NO2(g)为吸热反应,△H=akJ?mol-1,则生成物的总能量高akJ;活化能Ea=bkJ?mol-1,则反应物分子变为活化分子的能量为bkJ?mol-1,以此来解答.
(4)根据反应方程式判断熵变;△G=△H-T?△S进行判断,如△G<0,则反应能自发进行,如△G>0,则不能自发进行.
解答:
解:(1)当N2O4的起始浓度为0.50mol?L-1时,实验测得某温度时的平衡转化率(α)是10%,则达到平衡时N2O4的浓度为:c(N2O4)=0.5mol/L×(1-10%)=0.45mol,反应消耗的N2O4的浓度为:0.05mol/L,根据反应N2O4(g)?2NO2(g)可知,反应生成的四氧化二氮浓度为:c(NO2)=0.1mol/L,该温度时该反应的平衡常数K=
≈0.022;
平衡常数只受温度影响,温度不变,则平衡常数不变,
故答案为:0.022;不变;
(2)一定温度下,随着N2O4的起始浓度增大,增大了压强,该反应是体积增大的反应,则平衡向着逆向移动,四氧化二氮的转化率减小;
A.混合气体的颜色不在发生变化,体现中只有二氧化氮为有色气体,表明二氧化氮浓度不再变化,证明达到了平衡状态,故A正确;
B.N2O4和NO2的分子数之比为1:1,不能证明各组分的浓度不再变化,无法判断是否达到平衡状态,故B错误;
C.反应前后气体质量不变,该反应为气体体积增大的反应,则反应过程中混合气体的平均摩尔质量逐渐减小,当混合气体的平均摩尔质量不在发生变化,说明达到平衡状态,故C正确;
D.混合气体的质量不在发生变化,反应前后都是气体,所以气体的质量始终不变,无法根据质量变化判断平衡状态,故D错误;
故答案为:减小;AC;
(3)由于可逆反应N2O4(g)?2NO2(g)为吸热反应,且△H=akJ?mol-1,则生成物的总能量比反应物总能量大akJ;活化能Ea=bkJ?mol-1,则反应物分子变为活化分子的能量为bkJ?mol-1,满足条件的图象为D,
故答案为:D;
(4)反应N2O4(g)?2NO2(g)为气体体积增大的反应,则△S>0,该反应为吸热反应,则△H>0,反应能够自发进行,必须满足△G=△H-T?△S<0,由于△S>0、△H>0,则在较高温度下能够自发进行,
故答案为:>;较高.
| 0.12 |
| 0.45 |
平衡常数只受温度影响,温度不变,则平衡常数不变,
故答案为:0.022;不变;
(2)一定温度下,随着N2O4的起始浓度增大,增大了压强,该反应是体积增大的反应,则平衡向着逆向移动,四氧化二氮的转化率减小;
A.混合气体的颜色不在发生变化,体现中只有二氧化氮为有色气体,表明二氧化氮浓度不再变化,证明达到了平衡状态,故A正确;
B.N2O4和NO2的分子数之比为1:1,不能证明各组分的浓度不再变化,无法判断是否达到平衡状态,故B错误;
C.反应前后气体质量不变,该反应为气体体积增大的反应,则反应过程中混合气体的平均摩尔质量逐渐减小,当混合气体的平均摩尔质量不在发生变化,说明达到平衡状态,故C正确;
D.混合气体的质量不在发生变化,反应前后都是气体,所以气体的质量始终不变,无法根据质量变化判断平衡状态,故D错误;
故答案为:减小;AC;
(3)由于可逆反应N2O4(g)?2NO2(g)为吸热反应,且△H=akJ?mol-1,则生成物的总能量比反应物总能量大akJ;活化能Ea=bkJ?mol-1,则反应物分子变为活化分子的能量为bkJ?mol-1,满足条件的图象为D,
故答案为:D;
(4)反应N2O4(g)?2NO2(g)为气体体积增大的反应,则△S>0,该反应为吸热反应,则△H>0,反应能够自发进行,必须满足△G=△H-T?△S<0,由于△S>0、△H>0,则在较高温度下能够自发进行,
故答案为:>;较高.
点评:本题考查了化学平衡及其影响因素、化学反应与其能量变化、反应自发进行的判断,题目难度稍大,注意掌握影响化学平衡的因素,明确化学反应中能量变化的情况,能够根据△G=△H-T?△S判断反应能否自发进行.

练习册系列答案
相关题目
日常生活中一些事例常涉及到化学知识,下列分析不正确的是( )
| A、硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料 |
| B、用灼烧并闻气味的方法区别纯棉织物和纯毛织物 |
| C、某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2 |
| D、蒙古牧民喜欢用银器盛放鲜牛奶有其科学道理:用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质 |
 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: