题目内容
10.(1)如图1所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁条,再用滴管滴入5mL盐酸于试管中.试回答下列问题:①实验中观察到的现象是:镁片上有大量气泡,镁片逐渐溶解,烧杯中析出晶体.
②产生上述现象的原因是:镁与盐酸反应产生H2,该反应为放热反应,氢氧化钙在水中的溶解度随温度的升高而减小.
③写出有关反应的离子方程式:Mg+2H+=Mg2++H2↑.
(2)如图2是银锌原电池装置的示意图,以硫酸铜为电解质溶液.回答下列问题:
锌片上观察到的现象为锌溶解,锌为负极,该电极上发生氧化反应(“氧化”或“还原”),电极反应式为Zn-2e-=Zn2+.该原电池的总反应离子方程式为Zn+Cu2+=Zn2++Cu.
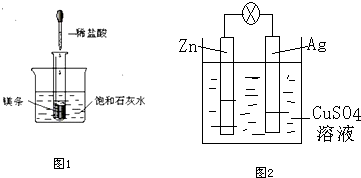
分析 (1)如图所示的实验中,所试管内滴入稀盐酸,盐酸与镁剧烈反应放出氢气,同时反应放出的热量使饱和石灰水溶液温度升高,温度升高氢氧化钙溶解度减小,饱和溶液析出固体氢氧化钙而使烧杯中的溶液变浑浊;
(2)该原电池中,Zn易失电子发生氧化反应而作负极,Ag作正极,负极上电极反应式为Zn-2e-=Zn2+,正极上电极反应式为Cu2++2e-=Cu,据此分析解答.
解答 解:(1)①镁与盐酸剧烈反应,可观察到产生大量气体,镁片逐渐溶解,烧杯中析出晶体氢氧化钙晶体,
故答案为:镁片上有大量气泡,镁片逐渐溶解,烧杯中析出晶体;
②镁与盐酸剧烈反应,产生氢气,该反应为放热反应,氢氧化钙在水中的溶解度随温度的升高而减小
故答案为:镁与盐酸反应产生H2,该反应为放热反应,氢氧化钙在水中的溶解度随温度的升高而减小;
③镁与盐酸发生置换反应,生成氯化镁和氢气,反应的离子方程式为:Mg+2H+=Mg2++H2↑,
故答案为:Mg+2H+=Mg2++H2↑;
(2)锌易失电子发生氧化反应而作负极,电极反应式为Zn-2e-=Zn2+,所以锌片上看到的现象是金属逐渐溶解,总的电极反应式为:Zn+Cu2+=Zn2++Cu,故答案为:锌溶解;负;氧化;Zn-2e-=Zn2+;Zn+Cu2+=Zn2++Cu.
点评 本题考查金属与酸的反应,该反应为放热反应,难度不大.要注意氢氧化钙的溶解度随温度升高而减小,但本题没考到这一点,是一点创新.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
20.下列相关说法不正确的是( )
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | 加入NaHCO3使氯水的漂白能力增强 | |
| C. | 难溶电解质可以由溶解度小的转化为溶解度更小的,但不能从溶解度小的转化为溶解度大的 | |
| D. | Ksp只受温度的影响,不受浓度的影响 |
5.通过下列有关实验研究影响化学反应速率的因素得出的相关结论,你认为不正确的是( )
| A. | 在其它条件相同时,将等质量的锌块和锌粉与相同浓度的盐酸反应,锌粉反应快 | |
| B. | 将质量相同、形状大小一样的铝条分别与稀硫酸和浓硫酸反应,浓硫酸产生氢气快 | |
| C. | 两支试管中分别加入双氧水,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 | |
| D. | 在稀硫酸和铁粉反应制取氢气时,加入适量醋酸钠晶体,可减慢反应速率 |
15.将乙醇、浓硫酸和乙酸混合,加热一段时间,再加入少量H218O,充分反应.下列说法中正确的是( )
| A. | 18O只存在于乙酸分子中 | |
| B. | 18O存在于乙酸和乙酸乙酯中分子中 | |
| C. | 18O只存在于乙醇分子中 | |
| D. | 18O存在于水、乙酸分子中 |
2.“拟晶”(quasicrystal)是一种具有凸多面体规则外形但不同于晶体的固态物质.Al65Cu23Fe12是二十世纪发现的几百种拟晶之一,具有合金的某些优良物理性能.下列有关这种拟晶的说法正确的是( )
| A. | 无法确定Al65Cu23Fe12中三种金属的化合价 | |
| B. | Al65Cu23Fe12的硬度小于金属铁 | |
| C. | Al65Cu23Fe12不可用作长期浸泡在海水中的材料 | |
| D. | 1mol Al65Cu23Fe12溶于过量的硝酸时共失去265 mol电子 |
19.硅及其化合物在材料领域中应用广泛.下列叙述不正确的是( )
| A. | 晶体硅是良好的半导体材料 | |
| B. | 硅单质可用来制造太阳能电池 | |
| C. | SiO2是制造光导纤维的材料 | |
| D. | 可用带玻璃塞的试剂瓶中盛有NaOH溶液 |
20.X、Y、Z、W均为短周期元素,原子序数依次增大.Y原子的M电子层有1个电子,同周期的简单离子的半径中Z最小.W与X同主族,其最高化合价是最低负化合价绝对值的3倍,下列说法正确的是( )
| A. | 最高价氧化物水化物的碱性:Y<Z | B. | 简单气态氢化物的热稳定性:X<W | ||
| C. | X分别与Z、W形成化合物的熔点:Z<W | D. | 简单离子的还原性:X<W |
