题目内容
能正确表示下列反应的离子方程式是( )
| A、硫酸铝溶液申加入过量氨水 Al3++3OH-═Al(OH)3↓ |
| B、碳酸钠溶液中加入澄清石灰水Ca(OH)2+CO32-═CaCO3↓+2OH- |
| C、冷的氢氧化钠溶液中通入氯气Cl2+2OH-═ClO-+Cl-+H2O |
| D、稀硫酸中加入铁粉2Fe+6H+═2Fe3++3H3↑ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.一水合氨为弱电解质,应保留化学式;
B.澄清石灰水,氢氧化钙应拆成离子形式;
C.冷的氢氧化钠溶液中通入氯气反应生成氯化钠、次氯酸钠和水;
D.不符合反应的客观事实.
B.澄清石灰水,氢氧化钙应拆成离子形式;
C.冷的氢氧化钠溶液中通入氯气反应生成氯化钠、次氯酸钠和水;
D.不符合反应的客观事实.
解答:
解:A.硫酸铝溶液申加入过量氨水,离子方程式:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故A错误;
B.碳酸钠溶液中加入澄清石灰水,离子方程式:Ca2++CO32-═CaCO3↓,故B错误;
C.冷的氢氧化钠溶液中通入氯气Cl2+2OH-═ClO-+Cl-+H2O,故C正确;
D.稀硫酸中加入铁粉生成硫酸亚铁,离子方程式:Fe+2H+═Fe2++H2↑,故D错误;
故选:C.
B.碳酸钠溶液中加入澄清石灰水,离子方程式:Ca2++CO32-═CaCO3↓,故B错误;
C.冷的氢氧化钠溶液中通入氯气Cl2+2OH-═ClO-+Cl-+H2O,故C正确;
D.稀硫酸中加入铁粉生成硫酸亚铁,离子方程式:Fe+2H+═Fe2++H2↑,故D错误;
故选:C.
点评:本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子方程式应遵循客观事实、遵循电荷、原子个数守恒规律,注意对微溶物化学式拆分的原则.

练习册系列答案
相关题目
有下列几个变化:①Na2CO3→Na2SiO3,②SiO2→H2SiO3;③Na2SiO3→Na2CO3;④Ca(NO3)2→CaSiO3,其中不能通过一步反应实现的是( )
| A、①② | B、②④ | C、③④ | D、只有② |
下列反应中,水既不是氧化剂,也不是还原剂,但反应是氧化还原反应的是( )
| A、2Na2O2+2H2O═4NaOH+O2↑ | ||||
B、C+H2O
| ||||
| C、Na2O+H2O═2NaOH | ||||
| D、2F2+2H2O═4HF+O2 |
国际无机化学命名委员会在1989年做出决定,把长式元素周期表原先的主副族及族号取消,由左到右改为18列.如碱金属元素为第1列,稀有气体元素为第18列.按此规定,下列说法错误的是( )
| A、第9列元素中没有非金属元素 |
| B、只有第2列元素原子最外层有2个电子 |
| C、第1列(H除外)和第17列元素的单质熔沸点变化趋势相反 |
| D、在整个18列元素中,第3列的元素种类最多 |
下列化学用语书写正确的是( )
A、氯离子的结构示意图: | ||
B、作为相对原子质量测定标准的碳核素:
| ||
C、氯化镁的电子式: | ||
D、用电子式表示氯化氢分子的形成过程: + + → →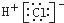 |
下列离子方程式与所述事实相符且正确的是( )
| A、Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O |
| B、向NaIO3溶液中加入适量NaHSO3溶液:IO3-+3HSO3-=I-+3SO42-+3H+ |
| C、明矾溶液中加入Ba(OH)2溶液至生成的沉淀物质的量最多:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| D、磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-=3Fe3++NO↑+4H2O |
测定Na2CO3和NaHCO3混合物中Na2CO3的质量分数x%可采取不同的方法,取a克样品与一定量稀盐酸(过量)充分反应后,下列说法正确的是( )
| A、逸出气体若用碱石灰吸收,增重b克,则x偏小 |
| B、把所得溶液加热蒸干并灼烧至恒重,得c克固体,若灼烧时有固体飞溅出去,x偏大 |
| C、某NaOH标准溶液露置于空气中一段时间后,以甲基橙为指示剂滴定上述反应后的溶液,则x偏小 |
| D、产生的气体冷却至室温后,若测定其体积时未调平量气管和水准管内液面,则x偏小 |
 目前机动车使用的电池品种不少,其中铅蓄电池的使用量最大.
目前机动车使用的电池品种不少,其中铅蓄电池的使用量最大.