题目内容
装置如图:关闭装置A中的止水夹a后,从长颈漏斗向试管中注入一定量的水,静置后如图所示;关闭图B装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶.则关于A、B两装置是否漏气的有关说法正确的是( )

| A、A装置肯定不漏气,B装置肯定漏气 |
| B、A装置肯定漏气,B装置可能不漏气 |
| C、A装置肯定不漏气,B装置肯定不漏气 |
| D、A装置肯定不漏气,B装置可能漏气也可能不漏气 |
考点:气体发生装置的气密性检查
专题:
分析:检查装置的气密性原理通常是想办法造成装置不同部位有压强差,并产生某种明显现象,如气泡的生成,水柱生成,液面升降.
解答:
解:当通过长颈漏斗向装置A中的试管内加水时,水在长颈漏斗内形成一段水柱,说明试管中密闭气体的压强大于外界大气压,说明装置气密性良好;橡皮管将B装置中两个容器内的气体连通,不管是否漏气,水在重力的作用下总能往烧瓶中流入,因此无法确定装置B是否漏气.
故选D.
故选D.
点评:本题考查气体发生装置的气密性检查,难度不大,注意掌握气密性检查的方法.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目
实验室有一瓶久置的白色K2SO3粉末,为确定其是否被氧化及其成分,元素分析表明粉末中K和S元素的质量比为39:16,下列结论正确的是( )
| A、根据测得的元素质量比可推测该粉末为纯净物 |
| B、将粉末溶于水,加入氯化钡,有白色沉淀生成,证明原粉末含K2SO4 |
| C、将粉末加入盐酸中,产生气泡,证明K2SO3未变质 |
| D、将粉末溶于水,加入氯化钡和过量的盐酸,有白色沉淀和气泡生成,证明原粉末是K2SO4和K2SO3的混合物 |
为了鉴定溴乙烷中溴元素的存在,试分析①~⑥的各步实验,其中操作顺序合理的是( )①加入AgNO3溶液 ②加入NaOH溶液 ③加热 ④加入蒸馏水 ⑤用HNO3酸化溶液⑥加入NaOH溶液醇溶液.
| A、①②③⑤ | B、②③⑤① |
| C、⑥③⑤① | D、④②⑤③ |
在蒸馏实验中,下列操作叙述不正确的是( )
A、在蒸馏烧瓶中盛约
| ||
| B、将温度计水银球与支管口保持水平 | ||
| C、冷水从冷凝管上口入,下口出 | ||
| D、收集蒸馏水时,应弃去开始馏出的部分 |
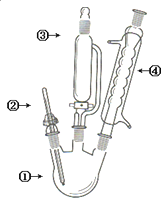 高中化学选修5《有机化学基础》第64页,有这样一个有机合成的装置图,有关下列仪器的名称和作用的叙述不正确的是( )
高中化学选修5《有机化学基础》第64页,有这样一个有机合成的装置图,有关下列仪器的名称和作用的叙述不正确的是( )| A、①三口烧瓶,用作反应器 |
| B、②为温度计,用于测量反应混合物的温度 |
| C、③为长颈漏斗,用于反应过程中添加反应液体 |
| D、④球形冷凝管,起冷凝、回流的作用,其冷水的进口在下方 |
 25摄氏度时,在20ml 0.1mol/L NaOH溶液中逐滴加入 0.2mol/L的醋酸溶液,曲线如图所示有关离子浓度关系的比较中,正确的是( )
25摄氏度时,在20ml 0.1mol/L NaOH溶液中逐滴加入 0.2mol/L的醋酸溶液,曲线如图所示有关离子浓度关系的比较中,正确的是( )| A、在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| B、在A点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| C、在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-) |
| D、在C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
下列说法正确的是( )
| A、原电池是把电能转化为化学能的装置 |
| B、原电池中电子流出的一极是正极发生氧化反应 |
| C、原电池的两极发生的反应均为氧化还原反应 |
| D、形成原电池后,原电池中的阳离子向正极移动 |
