题目内容
18. 铁和铝是两种重要的金属.请回答:
铁和铝是两种重要的金属.请回答:(1)两种金属制造的容器中,可以盛放冷的浓硫酸或浓硝酸的是Fe、Al(填化学式);通常可用于冶炼金属铝的方法是③(填序号).
①热分解法 ②热还原法 ③电解法
(2)常温下,铁跟水不反应,但红热的铁会跟水蒸气发生反应.写出该反应的化学方程式3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(3)在一个空的金属易拉罐内放入少量的某白色晶体,摇动几下后,立即向罐内注入6mol•L-1的氢氧化钠溶液10mL,迅速用胶布封严罐口.过一段时间后,罐壁凹而瘪;再过一段时间,瘪的罐壁重新鼓起.从实验可知,此易拉罐的金属为铝,造成罐壁再鼓起的反应的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑.
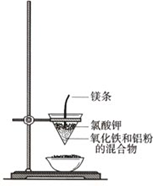
(4)使铝粉与氧化铁粉末在高温下发生反应(如图所示),该反应的化学方程式为Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,下列关于该实验的叙述正确的是②③④(填序号).
①可以观察到产生红棕色烟雾
②可以观察到发出耀眼的光芒
③可以观察到有熔融物生成
④通过引燃镁条放出的热量引发铝热反应.
分析 (1)浓硫酸具有强的氧化性室温下能够使铁铝发生钝化,生成致密的氧化膜,阻碍反应的进行;铝较活泼,通常用电解铝的氧化物进行冶炼;
(2)高温下铁会跟水蒸气发生反应生成四氧化三铁和氢气;
(3)CO2能和氢氧化钠发生反应,金属铝能和强碱反应生成氢气,利用瓶内压强变化来解释;
(4)通过引燃的镁条放出的热量引发铝热反应生成铁和氧化铝,并放出大量的热和耀眼的光,有熔融物生成.
解答 解:(1)浓硫酸具有强的氧化性室温下能够使铁铝发生钝化,生成致密的氧化膜,阻碍反应的进行;铝较活泼,通常用电解铝的氧化物进行冶炼,
故答案为:Fe、Al;③;
(2)高温下铁会跟水蒸气发生反应生成四氧化三铁和氢气,反应方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(3)CO2能和氢氧化钠发生反应CO2+2NaOH=Na2CO3+H20,CO2被吸收,使罐内气体压强减小而被外界大气压压瘪,因易拉罐是铝制的,过量的NaOH可以与罐壁(Al)反应:2Al+2OH-+2H2O═2AlO2-+3H2↑,产生氢气,导致压强增大,罐壁重新鼓起,
故答案为:铝;2Al+2OH-+2H2O═2AlO2-+3H2↑;
(4)氧化铁和铝粉混合,通过引燃的镁条放出的热量引发铝热反应生成铁和氧化铝,反应的化学方程式为Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,反应在高温条件下进行,并放出大量的热,镁条燃烧时发出耀眼的白光,有熔融物生成,
故答案为:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;②③④.
点评 本题考查了铝、铁的钝化、铝热反应、铝和碱液的反应等知识,侧重考查铝的性质,题目难度不大,注意铝热反应的原理和实验操作方法以及反应现象,学习中注意相关基础知识的积累.

| A. | 电解质与非电解质的本质区别:是在水溶液或熔化状态下能否电离 | |
| B. | 强电解质与弱电解质的本质区别:其水溶液导电性的强弱 | |
| C. | 胶体与溶液的本质区别:是否有丁达尔现象 | |
| D. | 氧化还原反应的本质:元素化合价在反应前后发生改变 |
| A. | H+、Fe2+、Mg2+、Cl- | B. | Cl-、CO32-、Cu2+、Mg2+ | ||
| C. | H+、NO3-、SO42-、K+ | D. | NO3-、OH-、Ba2+、Cl- |
| A. | 2mol/L HCl溶液 | B. | 5mol/L的NaOH溶液 | ||
| C. | 4 mol/L HNO3溶液 | D. | 18mol/L的H2SO4溶液 |

关于荧光素及氧化荧光素的叙述,正确的是( )
| A. | 互为同系物 | B. | 均可发生硝化反应 | ||
| C. | 均可与碳酸氢钠反应 | D. | 均最多有7个碳原子共平面 |
| A. | 透闪石的化学式写成氧化物的形式为2CaO•5MgO•8SiO2•H2O | |
| B. | 透闪石中Mg的质量分数是Ca的质量分数的1.5倍 | |
| C. | 1molCa2Mg5Si8O22(OH)2与足量盐酸作用,至少需要14molHCl | |
| D. | 透闪石是一种新型无机非金属材料,难溶于水 |
| A. | 2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=-4b kJ/mol | |
| B. | C2H2(g)+$\frac{5}{2}$O2(g) 2CO2(g)+H2O(l);△H=2b kJ/mol | |
| C. | 2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=-2b kJ/mol | |
| D. | 2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=b kJ/mol |
