题目内容
氧化镁在医药、建筑等行业应用广泛.硫酸镁还原热解制备高纯氧化镁是一种新的探索.以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如图:

(1)为了加快菱镁矿的溶解,在酸溶阶段可以采取的措施有(任写一条) .MgCO3 与稀硫酸反应的离子方程式为 .
(2)加入H2O2氧化时,发生反应的离子方程式为 .
(3)滤渣2的成分是 (填化学式).滤液A的主要成分有 (填化学式).
(4)煅烧过程存在以下反应:
2MgSO4(s)+C(s)═2MgO(s)+2SO2(g)+CO2(g)△H1
MgSO4(s)+C(s)═MgO(s)+SO2(g)+CO(g)△H2
MgSO4(s)+3C(s)═MgO(s)+S(g)+3CO(g)△H3
那么CO2(g)+C(s)═2CO(g)△H═ .
(5)该菱镁矿中MgCO3的含量为94.5%,那么1t该矿石理论上最多制取MgO t.

(1)为了加快菱镁矿的溶解,在酸溶阶段可以采取的措施有(任写一条)
(2)加入H2O2氧化时,发生反应的离子方程式为
(3)滤渣2的成分是
(4)煅烧过程存在以下反应:
2MgSO4(s)+C(s)═2MgO(s)+2SO2(g)+CO2(g)△H1
MgSO4(s)+C(s)═MgO(s)+SO2(g)+CO(g)△H2
MgSO4(s)+3C(s)═MgO(s)+S(g)+3CO(g)△H3
那么CO2(g)+C(s)═2CO(g)△H═
(5)该菱镁矿中MgCO3的含量为94.5%,那么1t该矿石理论上最多制取MgO
考点:镁、铝的重要化合物,化学方程式的有关计算,用盖斯定律进行有关反应热的计算
专题:元素及其化合物
分析:(1)加快化学反应速率的因素:加大接触面积、升高温度、增大物质的浓度;碳酸镁可以和强酸之间反应生成镁盐、水以及二氧化碳;
(2)双氧水具有氧化性,能将亚铁离子氧化为三价铁离子;
(3)根据流程中的转化关系确定各个物质,铁离子可以和氨水之间反应生成氢氧化铁;
(4)根据盖斯定律来计算化学反应的焓变;
(5)根据镁元素守恒进行计算.
(2)双氧水具有氧化性,能将亚铁离子氧化为三价铁离子;
(3)根据流程中的转化关系确定各个物质,铁离子可以和氨水之间反应生成氢氧化铁;
(4)根据盖斯定律来计算化学反应的焓变;
(5)根据镁元素守恒进行计算.
解答:
解:(1)为了加快菱镁矿的溶解,在酸溶阶段可以把矿石粉碎,加大接触面积,或是提高酸溶的温度,或是适当增大硫酸的浓度,碳酸镁可以和硫酸之间反应生成硫酸镁、水以及二氧化碳,即MgCO3+2H+═Mg2++CO2↑+H2O,故答案为:把矿石粉碎,或提高酸溶温度,或是适当增大硫酸的浓度;MgCO3+2H+═Mg2++CO2↑+H2O;
(2)双氧水具有氧化性,能将亚铁离子氧化为三价铁离子,自身被还原为水,即2Fe2++H2O2+2H+═2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(3)菱镁矿(主要成分为MgCO3,含少量FeCO3 )中加入硫酸,可以得到硫酸镁、硫酸铁的混合液,在加入氨水调节pH,可以将铁离子完全沉淀,同时生成硫酸铵,所以滤渣2的成分是氢氧化铁,滤液A的主要成分有MgSO4、(NH4)2SO4,故答案为:Fe(OH)3;MgSO4、(NH4)2SO4;
(4)已知:①2MgSO4(s)+C(s)═2MgO(s)+2SO2(g)+CO2(g)△H1
②MgSO4(s)+C(s)═MgO(s)+SO2(g)+CO(g)△H2
那么反应CO2(g)+C(s)═2CO(g)可以是②×2-①得到,所以该反应的△H=-△H1+2△H2,故答案为:-△H1+2△H2;
(5)菱镁矿中MgCO3的含量为94.5%,那么1t该矿石中含有碳酸镁中的质量是1t×94.5%=0.945t=9.45×105g,根据镁元素守恒,最多制取MgO的质量:
mol×40g/mol=4.5×105g=0.45t,故答案为:0.45.
(2)双氧水具有氧化性,能将亚铁离子氧化为三价铁离子,自身被还原为水,即2Fe2++H2O2+2H+═2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(3)菱镁矿(主要成分为MgCO3,含少量FeCO3 )中加入硫酸,可以得到硫酸镁、硫酸铁的混合液,在加入氨水调节pH,可以将铁离子完全沉淀,同时生成硫酸铵,所以滤渣2的成分是氢氧化铁,滤液A的主要成分有MgSO4、(NH4)2SO4,故答案为:Fe(OH)3;MgSO4、(NH4)2SO4;
(4)已知:①2MgSO4(s)+C(s)═2MgO(s)+2SO2(g)+CO2(g)△H1
②MgSO4(s)+C(s)═MgO(s)+SO2(g)+CO(g)△H2
那么反应CO2(g)+C(s)═2CO(g)可以是②×2-①得到,所以该反应的△H=-△H1+2△H2,故答案为:-△H1+2△H2;
(5)菱镁矿中MgCO3的含量为94.5%,那么1t该矿石中含有碳酸镁中的质量是1t×94.5%=0.945t=9.45×105g,根据镁元素守恒,最多制取MgO的质量:
| 9.45×105 |
| 84 |
点评:本题考查了镁、铁及其化合物的性质应用,物质性质熟练掌握是解题关键,注意元素守恒思想在计算中的应用,题目难度中等.

练习册系列答案
相关题目
我国重点城市近年来已发布“空气质量日报”.下列物质中不列入污染指数的是( )
| A、二氧化硫 | B、二氧化氮 |
| C、二氧化碳 | D、PM2.5 |
设NA代表阿伏加德罗常数的值,下列有关叙述正确的是( )
| A、0.1 mol Fe与足量的氯气反应时失去的电子数为0.2NA |
| B、标准状况下22.4L SO3含有的分子数为NA |
| C、6gSiO2晶体中含有的硅氧键数目为0.4NA |
| D、用Pt做电极电解硫酸铜溶液,当阳极产生的气体在标准状况下为22.4L时,转移电子数目为2NA |
NA为阿伏加德罗常数,下列叙述正确的是( )
| A、标准状况下,1mol氦气含有2NA个原子 |
| B、在常温常压下,11.2L二氧化硫所含的分子数目为0.5NA |
| C、5.6 g铁粉在0.1mol氯气中充分燃烧,失去的电子数为0.3NA |
| D、在常温常压下32g氧气所含的原子数目为2NA |
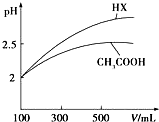 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示: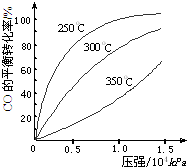 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.