题目内容
8.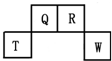 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:(1)W在周期表中的位置是第三周期VIA族,Q、R、T三种元素原子半径由大到小顺序为
Al>C>N(用元素符号表示),Q的最高价氧化物的电子式为
 ,R氢化物分子的结构式为
,R氢化物分子的结构式为 .
.(2)元素的原子得电子能力:Q弱于W(填“强于”或“弱于”).
(3)原子序数比R多1的元素有一种氢化物能分解为它的另一种氢化物,该反应的化学方程式为2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
分析 由短周期元素Q、R、T、W在元素周期表中的位置,可知Q、R处于第二周期,T、W处于第三周期,其中T所处的周期序数与主族序数相等,则T为Al,可推知Q为C元素、R为N元素、W为S元素,据此解答.
解答 解:由短周期元素Q、R、T、W在元素周期表中的位置,可知Q、R处于第二周期,T、W处于第三周期,其中T所处的周期序数与主族序数相等,则T为Al,可推知Q为C元素、R为N元素、W为S元素,
(1)W为S元素,原子序数为16,位于周期表中第三周期VIA族;
原子的电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小,则Q、R、T三种元素原子半径由大到小顺序为:Al>C>N;
CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ;
;
氨气中存在3个氮氢键,氨气的结构式为: ;
;
故答案为:第三周期VIA族;Al>C>N; ;
; ;
;
(2)酸性硫酸>碳酸,故元素的非金属性(得电子能力):C元素弱于S元素,
故答案为:弱于;
(3)原子序数比R多1的元素为O元素,氧元素一种氢化物能分解为它的另一种氢化物,为过氧化氢在二氧化锰作催化剂条件下分解生成水与氧气,该分解反应的化学方程式是:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
点评 本题考查了位置、结构与性质的关系,题目难度中等,推断元素为解答关键,注意熟练掌握元素周期律内容、元素周期表结构,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
19.下列物质中既含有离子键又含有共价键的是( )
| A. | HCl | B. | KOH | C. | I2 | D. | Na2 O |
3.向甲、乙、丙、丁四个容积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小的顺序排列正确的是( )
甲.在500℃时,10mol SO2和5mol O2反应
乙.在500℃时,用V2O5做催化剂,10mol SO2和5mol O2反应
丙.在450℃时,8mol SO2和5mol O2反应
丁.在500℃时,8mol SO2和5mol O2反应.
甲.在500℃时,10mol SO2和5mol O2反应
乙.在500℃时,用V2O5做催化剂,10mol SO2和5mol O2反应
丙.在450℃时,8mol SO2和5mol O2反应
丁.在500℃时,8mol SO2和5mol O2反应.
| A. | 甲、乙、丙、丁 | B. | 乙、甲、丙、丁 | C. | 乙、甲、丁、丙 | D. | 丁、丙、乙、甲 |
13.下列滴定反应不需要用指示剂的是( )
| A. | 硝酸银标准溶液滴定含氯离子的溶液[Ag++Cl-═AgCl↓] | |
| B. | 盐酸标准溶液滴定氨水[H++NH3•H2O═NH4++H2O] | |
| C. | Na2S2O3标准溶液滴定含单质碘的溶液[I2+2Na2S2O3(无色)═Na2S4O6 (无色)+2NaI] | |
| D. | 酸性高锰酸钾标准溶液滴定草酸溶液[2MnO4-+5H2C2O4+6H+═2Mn2+(无色)+10CO2↑+8H2O] |
17.同质量的锌与稀硫酸反应,欲使反应速率最大,选择下列组合中的反应条件( )
①锌粒②锌片
③锌粉
④10%的硫酸
⑤20%的硫酸
⑥98%的硫酸
⑦加热
⑧用冰冷却
⑨不断搅拌
⑩迅速加入锌后静置.
①锌粒②锌片
③锌粉
④10%的硫酸
⑤20%的硫酸
⑥98%的硫酸
⑦加热
⑧用冰冷却
⑨不断搅拌
⑩迅速加入锌后静置.
| A. | ②⑤⑦⑩ | B. | ①④⑧⑩ | C. | ③⑤⑦⑨ | D. | ③⑥⑦⑨ |
18.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1mol 羟基所含的电子数为7NA | |
| B. | 9.2 克甲苯含有的C-H 数目为0.8NA | |
| C. | 28g 聚乙烯含有的碳原子数为2nNA | |
| D. | 1mol 乙醇催化氧化生成乙醛时转移的电子数为4NA |
 ,F中的化学键为离子键、共价键;
,F中的化学键为离子键、共价键;