题目内容
9.P4(s,白磷)+5O2(g)═P4O10(s)△H1=-2983.2kJ/molP(s,红磷)+$\frac{5}{4}$O2(g)=$\frac{1}{4}$P4O2(s)△H2=-738.5/mol
(1)白磷转化为红磷的热化学方程式P4(s,白磷)═4P(s,红磷)△H=-29.2 kJ/mol.
相同的状况下,能量较低的是红磷;白磷的稳定性比红磷低(填“高”或“低”).
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热.已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量.
①反应的热化学方程式为N2H4(l)+2 H2O2(l)=N2(g)+4 H2O(g)△H=-641.63 kJ/mol.
②又已知H2O(l)=H2O(g);△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出热量是408.815KJ.
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是生成物为氮气和水,不污染空气.
分析 (1)利用盖斯定律可以解答,从待求反应出发,分析待求反应中的反应物和生成物在已知反应中的位置,通过相互加减可得.物质的能量越低越稳定;
(2)①强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热,依据题干条件结合化学方程式计算对应量的焓变,标注物质聚集状态写出热化学方程式;
②依据盖斯定律①-②×4得到:N2H4(l)+2 H2O2(l)=N2(g)+4 H2O(l)△H=-817.63kJ/mol,依据热化学方程式计算16g液态肼与液态双氧水反应生成液态水时放出的热量;
③燃烧产物无污染是其优点.
解答 解:(1)已知:P4(s,白磷)+5O2(g)═P4O10(s)△H=-2983.2kJ/mol ①,
P(s,红磷)+$\frac{5}{4}$O2(g)═$\frac{1}{4}$P4O10(s)△H=-738.5kJ/mol②,
据盖斯定律,①-②×4可得:P4(s,白磷)═4P(s,红磷)△H=-29.2 kJ/mol
从上面的热化学方程式可见,相同状况下,白磷比红磷能量高;因为能量越低越稳定,所以红磷比白磷稳定.
故答案为:P4(s,白磷)═4P(s,红磷)△H=-29.2 kJ/mol;红磷;低;
(2)①0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652kJ的热量,1mol液态肼和过氧化氢反应放热641.63 KJ,反应的热化学方程式为:
N2H4(l)+2 H2O2(l)=N2(g)+4 H2O(g)△H=-641.63 kJ/mol,
故答案为:N2H4(l)+2 H2O2(l)=N2(g)+4 H2O(g)△H=-641.63 kJ/mol;
②ⅠN2H4(l)+2 H2O2(l)=N2(g)+4 H2O(g)△H=-641.63 kJ/mol
ⅡH2O(l)=H2O(g)△H=+44kJ/mol
依据盖斯定律Ⅰ-Ⅱ×4得到:N2H4(l)+2 H2O2(l)=N2(g)+4 H2O(l)△H=-817.63kJ/mol,依据热化学方程式可知32g肼反应放热817.63KJ,则16g液态肼与液态双氧水反应生成液态水时放出的热量是408.815KJ,
故答案为:408.815;
③除释放大量热和快速产生大量气体外,生成物为氮气和水,不污染空气,
故答案为:生成物为氮气和水,不污染空气.
点评 本题考查了热化学方程式的书写方法和盖斯定律的计算应用,标注物质聚集状态,计算反应焓变是解题关键,题目较简单.

| A. | 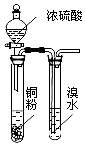 用图所示装置验证浓硫酸具有强氧化性 | |
| B. | 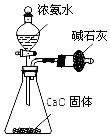 用图所示装罝制取干燥的 NH3 | |
| C. | 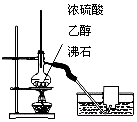 用图所示装置制取并收集乙烯 | |
| D. | 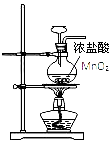 用图所示装置制取 Cl2 |
| A. | 2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO | B. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑ | ||
| C. | 3Mg+Fe2O3═3MgO+2Fe | D. | Al+Fe2O3═Al2O3+Fe |
| A. | 木材纤维和土豆淀粉遇碘水均显蓝色 | |
| B. | 食用花生油和鸡蛋清都能发生水解反应 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | 煤是混合物,含有大量的芳香烃 |
| A. | 充电时电池反应式为FePO4+Li═LiFePO4 | |
| B. | 放电时在正极上是Li+得电子被还原 | |
| C. | 放电时电池内部Li+向正极移动 | |
| D. | 充电时动力电池上“+”的电极与外接电源的负极相连 |
| A. | 燃料气和空气的进入量都减少 | |
| B. | 燃料气和空气的进入量都增大 | |
| C. | 减少燃料气进入量或增大空气进入量 | |
| D. | 增大燃料气进入量或减少空气进入量 |
 砷(As)是第四周期第VA族的元素,能形成多种化合物.回答下列问题:
砷(As)是第四周期第VA族的元素,能形成多种化合物.回答下列问题: .
.