题目内容
有A、B、C、D四种元素,其中A、B、C为短周期元素,A元素的周期数、主族数、原子序数均相同,BO3-离子含有32个电子,C元素的原子最外层电子数比次外层电子数少2个,C的阴离子与D的阳离子具有相同的电子层结构,C和D可形成化合物D2C,请回答:
(1)A、B、C、D四种元素的符号分别是 、 、 、 .
(2)A、B两种元素形成化合物的电子式为 ,杂化类型为 ,空间构型为 形.
(3)A、B、C可形成两种既含离子键又含共价键的化合物,它们的化学式分别是 和 .
(4)D2C的形成过程用电子式表示为 .
(1)A、B、C、D四种元素的符号分别是
(2)A、B两种元素形成化合物的电子式为
(3)A、B、C可形成两种既含离子键又含共价键的化合物,它们的化学式分别是
(4)D2C的形成过程用电子式表示为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D四种元素,其中A、B、C为短周期元素,A元素的周期数、主族数、原子序数均相同,所以A为氢元素,BO3-离子含有32个电子,则B为氮元素,C元素的原子最外层电子数比次外层电子数少2个,且C为短周期元素,所以C为硫元素,C的阴离子与D的阳离子具有相同的电子层结构,C和D可形成化合物D2C,则D为钾元素,据此答题;
解答:
解:A、B、C、D四种元素,其中A、B、C为短周期元素,A元素的周期数、主族数、原子序数均相同,所以A为氢元素,BO3-离子含有32个电子,则B为氮元素,C元素的原子最外层电子数比次外层电子数少2个,且C为短周期元素,所以C为硫元素,C的阴离子与D的阳离子具有相同的电子层结构,C和D可形成化合物D2C,则D为钾元素,
(1)由上述推断可知,A为H,B为N,C为S,D为K,
故答案为:H;N;S;K;
(2)A、B形成的化合物为NH3,其电子式为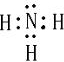 ,由于N原子的价层电子对数为
,由于N原子的价层电子对数为
=4,所以N原子杂化类型为sp3杂化,分子中有一对孤电子对,所以氨分子的空间构型为三角锥形,
故答案为: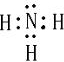 ;sp3杂化;三角锥;
;sp3杂化;三角锥;
(3)H、N、S可形成两种既含离子键又含共价键的化合物,它们的化学式分别是(NH4)2S和NH4HS,
故答案为:(NH4)2S;NH4HS;
(4)K最外层1个电子,S最外层6个电子,则用电子式表示K2S的形成过程为 ,
,
故答案为: .
.
(1)由上述推断可知,A为H,B为N,C为S,D为K,
故答案为:H;N;S;K;
(2)A、B形成的化合物为NH3,其电子式为
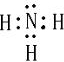 ,由于N原子的价层电子对数为
,由于N原子的价层电子对数为| 5+3 |
| 2 |
故答案为:
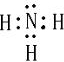 ;sp3杂化;三角锥;
;sp3杂化;三角锥;(3)H、N、S可形成两种既含离子键又含共价键的化合物,它们的化学式分别是(NH4)2S和NH4HS,
故答案为:(NH4)2S;NH4HS;
(4)K最外层1个电子,S最外层6个电子,则用电子式表示K2S的形成过程为
 ,
,故答案为:
 .
.
点评:本题主要考查了电子式、原子杂化方式、分子空间构型、化学键等知识,难度不大,解题的关键是元素推断,答题时注意审题,充分用好题中条件进行元素推断.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
某元素的原子L电子层比M电子层多3个电子,下列说法中不正确的是( )
| A、该元素一定是短周期元素 |
| B、该元素容易和H2化合生成气态氢化物 |
| C、该元素是非金属元素 |
| D、该元素最高化合价为+5价 |
 推销净水器的商人用自来水做电解实验,一段时间后两极间产生灰绿色沉淀,并很快变成红褐色,然后用净水器净化后的水做电解实验,两极上只有气体产生,水中并无沉淀,用以证明自来水很“脏”.人们将自来水送检,却是合格的,下列有关说法,合理的是( )
推销净水器的商人用自来水做电解实验,一段时间后两极间产生灰绿色沉淀,并很快变成红褐色,然后用净水器净化后的水做电解实验,两极上只有气体产生,水中并无沉淀,用以证明自来水很“脏”.人们将自来水送检,却是合格的,下列有关说法,合理的是( )| A、商人电解自来水时,用石墨做阳极;电解净化水时,用铁做阳极 |
| B、电解自来水时,阴极反应式:O2+2H2O+4e-═4OH- |
| C、电解净化水时,a、b两极的pH变化如图2所示 |
| D、电解自来水实验中,若阴极产生气体为3.36L(标况),则阳极质量减小5.6克 |
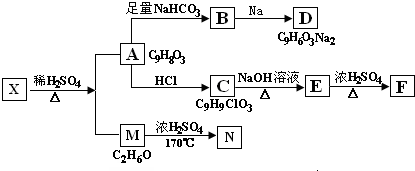
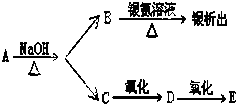 有机物A、B、C、D、E有如下衍生关系,又知C和E在浓H2SO4作用下加热,得到一种具有果香味的液体,分子式为C4H8O2.试写出A、B、C、D、E的结构简式.
有机物A、B、C、D、E有如下衍生关系,又知C和E在浓H2SO4作用下加热,得到一种具有果香味的液体,分子式为C4H8O2.试写出A、B、C、D、E的结构简式.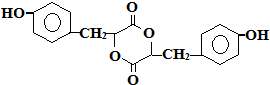 .
.