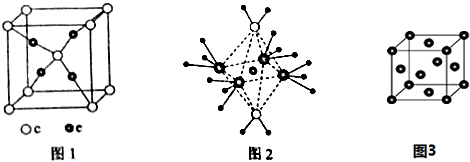
题目内容
关于氢键,下列说法正确的是( )
| A、氢键属于共价键 |
B、因为分子间存在氢键的缘故, 比 比 熔沸点高 熔沸点高 |
| C、由于氢键比范德华力强,所以H2O分子比H2S分子稳定 |
| D、1mol冰中有4mol氢键 |
考点:氢键的存在对物质性质的影响,含有氢键的物质
专题:
分析:A.氢键是一种较强的分子间作用力,不是化学键;
B.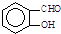 中两个基团靠得很近,与
中两个基团靠得很近,与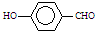 相比,不容易形成分子间氢键;
相比,不容易形成分子间氢键;
C.H-O键的键能比H-S键的键能大;
D.每个H2O分子通过氢键与4个H2O分子结合.
B.
 中两个基团靠得很近,与
中两个基团靠得很近,与 相比,不容易形成分子间氢键;
相比,不容易形成分子间氢键;C.H-O键的键能比H-S键的键能大;
D.每个H2O分子通过氢键与4个H2O分子结合.
解答:
解:A.氢键属于分子间作用力,不属于共价键,故A错误;
B.. 中两个基团靠得很近,形成分子内氢键,使熔沸点偏低;而
中两个基团靠得很近,形成分子内氢键,使熔沸点偏低;而 的两个基团靠得较远,容易形成分子间氢键,使熔沸点偏高,故
的两个基团靠得较远,容易形成分子间氢键,使熔沸点偏高,故 比
比 的熔沸点高,故B正确;
的熔沸点高,故B正确;
C.H-O键的键能比H-S键的键能大,故H2O分子比H2S分子稳定,故C错误;
D.每个H2O分子通过氢键与4个H2O分子结合,故1mol冰中有1mol×4×0.5=2mol氢键,故D错误;
故选B.
B..
 中两个基团靠得很近,形成分子内氢键,使熔沸点偏低;而
中两个基团靠得很近,形成分子内氢键,使熔沸点偏低;而 的两个基团靠得较远,容易形成分子间氢键,使熔沸点偏高,故
的两个基团靠得较远,容易形成分子间氢键,使熔沸点偏高,故 比
比 的熔沸点高,故B正确;
的熔沸点高,故B正确;C.H-O键的键能比H-S键的键能大,故H2O分子比H2S分子稳定,故C错误;
D.每个H2O分子通过氢键与4个H2O分子结合,故1mol冰中有1mol×4×0.5=2mol氢键,故D错误;
故选B.
点评:本题考查氢键的相关知识,题目难度不大.要注意氢键的形成以及对物质性质的影响.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
下列说法中错误的是( )
| A、从2L1mol?L-1的NaCl溶液中取出10 mL,其浓度仍是1 mol?L-1 |
| B、制成0.5L 1 mol?L-1的盐酸,需标准状况下氯化氢气体11.2 L |
| C、1L1mol?L-1 BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023 |
| D、10g98%硫酸(密度为1.84g?cm-3)与10mL 18.4 mol?L-1硫酸的浓度是不同的 |
下列物质,属于强电解质的( )
| A、NH3?H2O |
| B、H2O |
| C、NaHCO3 |
| D、NaOH溶液 |
某反应2AB(g)?C(g)+3D(g)只有在高温时才能自发进行,则该反应的△H、△S应为( )
| A、△H<0,△S>0 |
| B、△H<0,△S<0 |
| C、△H>0,△S>0 |
| D、△H>0,△S<0 |
下列各物质中所含有的分子数最多的是( )
| A、标准状况下11.2 L氯气 |
| B、17g氨气(NH3) |
| C、1.204×1024个H2O分子 |
| D、0.8mol氧气 |
下列说法不正确的是( )
| A、将标准状况下11.2L HCl溶于水,配成250mL盐酸,溶液的物质的量浓度为2mol/L |
| B、硫酸和磷酸的摩尔质量相等 |
| C、同温同压下,相同质量的二氧化碳和二氧化硫的体积比是16:11 |
| D、2.24L CO和CO2混合气体中含有的碳原子数目为0.1NA |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、甲基橙呈红色的溶液中:MnO4-、Al3+、C2H5OH、SO42- |
| B、常温下的溶液:KW/c(H+)=0.1mol/L的溶液:K+、Na+、SiO32-、NO3- |
| C、稀硫酸中:K+、Mg2+、AlO2-、S2O32- |
| D、加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- |
近年来,华北多个地区发生持续雾霾天气,“PM2.5”数据监测纳入公众视野.“PM2.5”是指大气中直径小于或等于2.5微米的细小颗粒物,也称为可入肺颗粒物.下列有关说法中,错误的是( )
| A、雾属于胶体,能产生丁达尔现象 |
| B、目前的雾霾污染,无需治理借助于天气状况改善即可 |
| C、PM2.5颗粒含有重金属、多种烃等有毒物质 |
| D、汽车尾气是目前城市大气污染气体和细小颗粒物产生的一个重要来源 |