题目内容
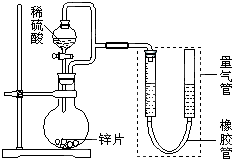 某同学设计了如图所示装置(部分夹持装置已略去)进行实验研究.据此回答下列问题:
某同学设计了如图所示装置(部分夹持装置已略去)进行实验研究.据此回答下列问题:(1)用上述装置探究影响化学反应速率的因素.
①圆底烧瓶中发生反应的离子方程式是
②用上述装置进行实验,以生成9.0mL气体为计时终点,相关数据如下表,所耗时间t1>t2.比较实验Ⅰ和Ⅱ可以得出的实验结论是
| 序号 | V(H2SO4)/mL | c(H2SO4)/mol?L-1 | t/s |
| Ⅰ | 40 | 1 | t1 |
| Ⅱ | 40 | 4 | t2 |
A.石墨 B.银 C.铜 D.沙粒(二氧化硅)
(2)量气管在读数前,除了要恢复至常温外,还要进行的操作是
考点:探究影响化学反应速率的因素
专题:实验设计题
分析:(1)①锌与稀硫酸反应生成硫酸锌和氢气,据此写出反应的离子方程式;
②t1>t2,说明实验Ⅱ反应速率较大,二者浓度不同,根据物质的量浓度对反应速率的影响解答;
③测得的反应速率均大于上述实验对应的数据,化学反应速率增大,所含杂质与锌可形成原电池而加快反应速率,据此判断;
(2)为了避免压强对测定结果的影响,对量气管读数时需要调整左右两管的液面高度相平,且视线与液面相平.
②t1>t2,说明实验Ⅱ反应速率较大,二者浓度不同,根据物质的量浓度对反应速率的影响解答;
③测得的反应速率均大于上述实验对应的数据,化学反应速率增大,所含杂质与锌可形成原电池而加快反应速率,据此判断;
(2)为了避免压强对测定结果的影响,对量气管读数时需要调整左右两管的液面高度相平,且视线与液面相平.
解答:
解:(1)①锌与稀硫酸反应生成硫酸锌和氢气,反应的离子方程式为:Zn+2H+=Zn2++H2↑,
故答案为:Zn+2H+=Zn2++H2↑;
②t1>t2,说明实验Ⅱ反应速率较大,二者浓度不同,说明在其它条件一定时,化学反应速率随反应物浓度的增大而增大,
故答案为:其他条件不变时,增大反应浓度可加快反应速率;
③由反应速率大于上述实验对应的数据可知所含杂质必能与锌形成原电池,使反应速率增大,所含杂质可以是比锌不活泼的:石墨、银、铜等,所以ABC正确,
故答案为:ABC;
(2)对量气管读数时,要注意调整左右两管的液面高度相平,且视线与液面相平,避免压强影响测定结果,
故答案为:上下移动量气管,使左右两管液面高度相同.
故答案为:Zn+2H+=Zn2++H2↑;
②t1>t2,说明实验Ⅱ反应速率较大,二者浓度不同,说明在其它条件一定时,化学反应速率随反应物浓度的增大而增大,
故答案为:其他条件不变时,增大反应浓度可加快反应速率;
③由反应速率大于上述实验对应的数据可知所含杂质必能与锌形成原电池,使反应速率增大,所含杂质可以是比锌不活泼的:石墨、银、铜等,所以ABC正确,
故答案为:ABC;
(2)对量气管读数时,要注意调整左右两管的液面高度相平,且视线与液面相平,避免压强影响测定结果,
故答案为:上下移动量气管,使左右两管液面高度相同.
点评:本题考查化学反应速率以及金属的电化学腐蚀的实验探究,题目难度中等,答题时注意实验数据的处理、分析,把握实验原理、根据实验现象得出实验结论.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
欲除去CaCl2溶液中混有的少量FeCl3,最后加入的试剂为( )
| A、氢氧化钠 | B、氧化钙 |
| C、碳酸钠 | D、碳酸钙 |
下列分离和提纯的实验中,所选用的方法或仪器不正确的是( )
| 序号 | A | B | C | D |
| 实验目的 | 分离食盐水与泥沙 | 分离水和CCl4 | 制取蒸馏水 | 从浓食盐水中得到氯化钠晶体 |
| 分离方法 | 过滤 | 萃取 | 蒸馏 | 蒸发 |
| 选用仪器 |  |  |  |  |
| A、A | B、B | C、C | D、D |
有下列试剂 ①KSCN ②淀粉-碘化钾溶液 ③Fe ④Cu ⑤H2S ⑥NH3?H2O ⑦Na2CO3溶液,和三氯化铁溶液反应时,使Fe 3+表现出氧化性的试剂有( )
| A、①⑥⑦ | B、②③④⑤ |
| C、④⑤⑥⑦ | D、全部 |
 图中 A、B、C、D、E均为有机化合物.已知:C能跟NaHCO3发生反应;C和D的相对分子质量相等,且E为无支链的化合物.根据图回答问题:
图中 A、B、C、D、E均为有机化合物.已知:C能跟NaHCO3发生反应;C和D的相对分子质量相等,且E为无支链的化合物.根据图回答问题: