题目内容
16.有Al2(SO4)3和Na2SO4的混合溶液VL,将它均分成两份.一份滴加氨水,使Al3+离子完全沉淀;另一份滴加BaCl2溶液,使SO42-离子完全沉淀.反应中消耗a mol NH3•H2O、b mol BaCl2.据此得知原混合溶液中的c(Na+)(mol/L)为( )| A. | $\frac{4b-2a}{V}$ | B. | (2b-2a)/V | C. | (2b-a)/V | D. | (b-2a)/V |
分析 第一份发生的离子反应方程式为Al3++3NH3.H2O=Al(OH)3↓+3NH4+、第二份发生的离子反应方程式为Ba2++SO42-=BaSO4↓,
根据Al3++3NH3.H2O=Al(OH)3↓+3NH4+得n(Al3+)=$\frac{1}{3}$n(NH3.H2O)=$\frac{a}{3}$mol,
则混合溶液中c(Al3+)=$\frac{\frac{a}{3}mol}{\frac{V}{2}L}$=$\frac{2a}{3V}$mol/L;
根据Ba2++SO42-=BaSO4↓得n(Ba2+)=n(SO42-)=bmol,则c(SO42-)=$\frac{bmol}{\frac{V}{2}L}$=$\frac{2b}{V}$mol/L,
任何电解质溶液都呈电中性,根据电荷守恒计算c(Na+).
解答 解:第一份发生的离子反应方程式为Al3++3NH3.H2O=Al(OH)3↓+3NH4+、第二份发生的离子反应方程式为Ba2++SO42-=BaSO4↓,
根据Al3++3NH3.H2O=Al(OH)3↓+3NH4+得n(Al3+)=$\frac{1}{3}$n(NH3.H2O)=$\frac{a}{3}$mol,
则混合溶液中c(Al3+)=$\frac{\frac{a}{3}mol}{\frac{V}{2}L}$=$\frac{2a}{3V}$mol/L;
根据Ba2++SO42-=BaSO4↓得n(Ba2+)=n(SO42-)=bmol,则c(SO42-)=$\frac{bmol}{\frac{V}{2}L}$=$\frac{2b}{V}$mol/L,
任何电解质溶液都呈电中性,根据电荷守恒得c(Na+)=2c(SO42-)-3c(Al3+)=$\frac{4b}{V}$mol/L-$\frac{2a}{V}$mol/L=$\frac{4b-2a}{V}$mol/L,故选A.
点评 本题考查混合物的计算,侧重考查分析计算能力,明确各个物理量之间的关系式是解本题关键,利用电荷守恒解答即可,注意每份溶液体积不是VL,为易错题.

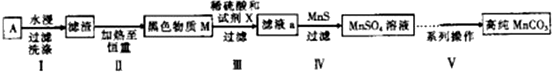
(1)碱性锌锰干电池的负极材料是Zn(填化学式).
(2)第Ⅱ步操作的目的是除去碳粉.
(3)第Ⅳ步操作是对滤液a进行深度除杂,除去Zn2+的离子方程式为Zn2++MnS=ZnS+Mn2+.(已知:Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24)
(4)为选择试剂X,在相同条件下,分别用5g 黑色物质M进行制备MnSO3的实验,得到数据如下表:
| 实验编号 | 试剂X | MnSO4/g |
| 1 | 锌粉 | 2.3595 |
| 2 | 铁粉 | 2.7184 |
| 3 | 硫化亚铁 | 2.9911 |
| 4 | 30%过氧化氢 | 3.7349 |
②第Ⅲ步中用选出的最佳试剂X与M的主要成分反应的化学方程式为MnO2+H2O2+H2SO4=MnSO4+2H2O+O2↑.
(5)已知:MaCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH为7.请补充完成以下操作:
第Ⅴ步系列操作可按一下流程进行:请补充完成操作:(第Ⅴ步系列操作中可供选用的试剂:NaHCO3、乙醇)
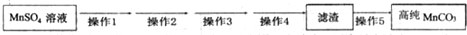
操作1:加入NaHCO3,控制pH<7.7;
操作2:过滤,用少量水洗涤2~3次
操作3:检测滤液,表明SO42-已除干净;
操作4:用少量无水乙醇洗涤2~3次;
操作5:低温烘干.
(6)操作1可能发生反应的离子方程式Mn2++2HCO3-=MnCO3↓+H2O+CO2↑.
| 二甲苯一溴代物的熔点/℃ | 234 | 206 | 213 | 204 | 214 | 205 |
| 对应的二甲苯的熔点/℃ | 13 | -54 | -27 | -54 | -27 | -54 |
| A. | 熔点为234℃的是一溴代间二甲苯 | B. | 熔点为234℃的是一溴代邻二甲苯 | ||
| C. | 熔点为-54℃的是间二甲苯 | D. | 熔点为-27℃的是对二甲苯 |
| A. | Na | B. | P | C. | S | D. | C |
| A. | 32 | B. | 67 | C. | 99 | D. | 166 |
| A. | 卤素单质的最外层电子数都是7 | |
| B. | 从上到下,卤素原子的电子层数依次增多,半径依次减小 | |
| C. | 卤素单质与H2化合的容易程度为F2<Cl2<Br2<I2 | |
| D. | 从F到I,原子核对最外层电子的吸引能力依次减弱,原子得电子能力依次减弱,元素的非金属性依次减弱 |
| A. | 一定无Na2CO3,可能有FeCl3 | B. | 一定有MgCl2,一定无NaCl | ||
| C. | 一定有MgCl2,可能有Na2CO3 | D. | 一定有MgCl2,可能有NaCl |
 ;Na2O2的电子式:
;Na2O2的电子式: ,H2S的电子式:
,H2S的电子式:
 .
. .
.