题目内容
6.某CaCl2样品中混有FeCl3、MgCl2、NaCl和Na2CO3中的一种或几种杂质.取11.1g样品溶解,得无色溶液,再加入足量AgNO3溶液,得到29.7g沉淀.则样品中( )| A. | 一定无Na2CO3,可能有FeCl3 | B. | 一定有MgCl2,一定无NaCl | ||
| C. | 一定有MgCl2,可能有Na2CO3 | D. | 一定有MgCl2,可能有NaCl |
分析 样品溶于水得无色溶液,证明氯化钙样品中一定不含碳酸钠,氯化铁;因为碳酸钠和氯化钙会生成沉淀,氯化铁溶液是棕黄色溶液;根据纯氯化钙和硝酸银生成氯化银的质量和题中混有氯化镁、氯化钠中的物质生成氯化银的质量进行比较分析.
解答 解:纯净的11.1g氯化钙生成的沉淀质量是x
CaCl2~2AgCl
111 287
11.1 x
所以沉淀量是28.7g,纯净的11.1g氯化镁生成的沉淀质量是z,
MgCl2~2AgCl
95 287
11.1 z
所以沉淀量是33.5g,纯净的11.1g氯化钠生成的沉淀量是m,
NaCl~AgCl
58.5 143.5
11.1 m
所以沉淀量是27.2g,因为氯化钙生成的沉淀量小于29.7,所以另一种物质的生成的沉淀量要大于29.7,一定含有氯化镁,可能含有氯化钠;
A、依据样品溶于水得无色溶液,证明氯化钙样品中一定不含碳酸钠,氯化铁,故A错误;
B、过计算分析,一定有氯化镁,可能有氯化钠,故B错误;
C、依据样品溶于水得无色溶液,证明氯化钙样品中一定不含碳酸钠,氯化铁,故C错误;
D、通过计算分析,一定有氯化镁,可能有氯化钠,故D正确;
故选D.
点评 本题考查了混合物的计算应用和判断,在解此类题时,可以应用假设法假设所给质量是纯净物的质量,计算出生成的沉淀,再用均衡法进行分析解答.

练习册系列答案
相关题目
16.有Al2(SO4)3和Na2SO4的混合溶液VL,将它均分成两份.一份滴加氨水,使Al3+离子完全沉淀;另一份滴加BaCl2溶液,使SO42-离子完全沉淀.反应中消耗a mol NH3•H2O、b mol BaCl2.据此得知原混合溶液中的c(Na+)(mol/L)为( )
| A. | $\frac{4b-2a}{V}$ | B. | (2b-2a)/V | C. | (2b-a)/V | D. | (b-2a)/V |
17.除去下列物质中的少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 溴苯(溴) | 氢氧化钠溶液 | 过滤 |
| B | 苯(甲苯) | 酸性高锰酸钾溶液 | 分液 |
| C | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| D | 溴乙烷(乙醇) | 蒸馏水 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
14.X、Y两元素可形成X2Y3型化合物,则X、Y原子基态时外围的电子排布可能是( )
| A. | X:3s23p1 Y:3s23p5 | B. | X:3d64s2 Y:2s22p4 | ||
| C. | X:3s23p2 Y:2s22p4 | D. | X:3s2 Y:2s22p3 |
1.氯气跟碘在加热条件下,以等物质的量进行反应,可得到一种红棕色液体ICl.ICl有很强的氧化性,ICl跟Zn、H2O反应的化学方程式为:2ICl+2Zn=ZnCl2+ZnI2、ICl+H2O=HCl+HIO,下列叙述中正确的是( )
| A. | ZnCl2既是氧化产物,又是还原产物 | |
| B. | ICl跟H2O的反应是自身氧化还原反应 | |
| C. | ZnI2既是氧化产物,又是还原产物 | |
| D. | 在ICl跟H2O的反应中,ICl是氧化剂,H2O是还原剂 |
16.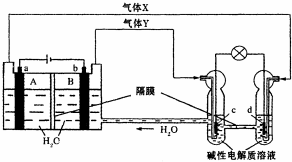 中国首个空间实验室--“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),它是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.下图为RFC工作原理示意图,a、b、c、d均为Pt电极.下列说法正确的是( )
中国首个空间实验室--“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),它是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.下图为RFC工作原理示意图,a、b、c、d均为Pt电极.下列说法正确的是( )
 中国首个空间实验室--“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),它是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.下图为RFC工作原理示意图,a、b、c、d均为Pt电极.下列说法正确的是( )
中国首个空间实验室--“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),它是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.下图为RFC工作原理示意图,a、b、c、d均为Pt电极.下列说法正确的是( )| A. | B区的OH-通过隔膜向a电极移动,A区pH增大 | |
| B. | 图中右管中的OH-通过隔膜向c电极移动,d电极上发生还原反应 | |
| C. | c是正极,电极上的电极反应为:2H++2e-=H2↑ | |
| D. | 当有1mol电子转移时,b电极产生气体Y的体积为11.2L |

 .
. .
.