题目内容
7.现有部分被氧化的Cu-Fe合金粉末8.96g,将其进行如下处理
下列说法正确的是( )
| A. | 滤渣B中一定含有Cu,可能含有Fe | |
| B. | 向滤液C中滴入KSCN溶液,溶液可能变红色 | |
| C. | 合金粉末中可能含5.68gCuO | |
| D. | 气体A在标准状况下的体积为224mL |
分析 硫酸足量,氧化性:Fe3+>Cu2+>H+,铁离子优先反应,由于有气体氢气生成,则滤液C中不含铁离子,滤渣4.8g为金属铜,物质的量为$\frac{4.8g}{64g/mol}$=0.075mol,即合金样品中总共含有铜元素0.075mol,利用极限法判断样品中CuO的质量问题;
滤液C中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体4.8g为Fe2O3,物质的量为0.03mol,铁元素的物质的量为0.06mol,滤液C溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.06mol,说明参加反应硫酸物质的量为0.06mol,硫酸含氢离子0.12mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,计算合金中氧元素的质量,进而计算合金中氧原子的物质的量,计算氧原子结合氢离子物质的量,再根据H原子守恒生成氢气的体积.
解答 解:A.由于硫酸足量,且铁与硫酸反应,则滤渣B中一定不含铁,故A错误;
B.滤液C中不含铁离子,滴加KSCN不不变色,故B错误;
C.由以上分析可知合金样品中总共含有铜元素0.075mol,如全部生成CuO,则质量为0.075mol×80g/mol=6g,由于部分铜被氧化成氧化铜,则样品中氧化铜的质量一定小于6g,但是不能确定CuO的具体质量,故C错误;
D.滤液C中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体4.8g为Fe2O3,物质的量为0.03mol,铁元素的物质的量为0.06mol,滤液C溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.06mol,说明参加反应硫酸物质的量为0.06mol,硫酸含氢离子0.12mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,合金中Fe元素质量=0.06mol×56g/mol=3.36g,故合金中氧原子的物质的量$\frac{8.96g-4.8g-3.36g}{16g/mol}$=0.05mol,它结合氢离子0.1mol,所以硫酸中有0.12mol-0.1mol=0.02mol H+生成氢气,即生成0.01mol氢气,标况体积=0.01mol×22.4L/mol=0.224L=224mL,故D正确;
故选D.
点评 本题考查无机物的推断,为高频考点,清楚反应过程是解答关键,侧重解题方法与分析解决问题能力的考查,注意利用极限法与原子守恒解答,难度中等.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案| A. | 肯定有电子得失 | |
| B. | 肯定是有关氧元素的反应 | |
| C. | 肯定有化合价的变化 | |
| D. | 氧化剂得到电子总数与还原剂失去电子总数相等 |
| A. | 氧化剂和还原剂的物质的量之比为1:8 | |
| B. | 该过程说明Fe(NO3)2溶液不宜加酸酸化 | |
| C. | 每1 mol NO3-发生还原反应,转移6 mol e- | |
| D. | 若把该反应设计为原电池,则负极反应为Fe2+-e-═Fe3+ |
| A. | 稀硫酸与Ba(OH)2溶液反应生成1 mol水 | |
| B. | 稀盐酸与氨水反应生成1 mol H2O | |
| C. | 1 mol稀H2SO4与足量NaOH溶液反应 | |
| D. | 稀盐酸与稀Ba(OH)2溶液反应生成1 mol水 |
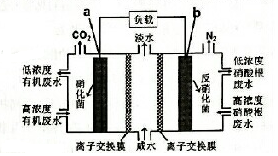 一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法的是( )
一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法的是( )| A. | a电极为该电池的正极 | |
| B. | 电极b的反应式:2NO3--10e-+12H+=N2↑+6H2O | |
| C. | 每处理1molC8H10O5,b电极将产生3.2molN2 | |
| D. | a电极离子交换膜允许Na+白中间空迁有机废水处理室 |
| A. | 干冰升华 | B. | 氯气液化 | C. | 海水晒盐 | D. | 钢铁生锈 |
| A. | 金刚石、石墨、C60互为同素异形体,它们形成的晶体都是分子晶体 | |
| B. | 乙烯、苯分子中所有原子都在同一个平面上 | |
| C. | 氨基酸分子中均含有羧基(-COOH)和氨基(-NH2)官能团 | |
| D. | (CH3)2CHCH(CH3)2的名称是2,3-二甲基丁烷 |
| A. | Cl-、HCO3-、Na+、K+ | B. | Fe3+、NO3-、K+、H+ | ||
| C. | NO3-、Ba2+、K+、Cl- | D. | Al3+、SO42-、NH4+、Cl- |