题目内容
13.常温下,二元弱酸H2XOn第一、第二步电离的平衡常数为K1、K2,下列关于KHXOn溶液的说法正确的是( )| A. | 溶质的电离方程式为KHXOn═K++H++XOn2- | |
| B. | 该溶液中水的电离程度比纯水的小 | |
| C. | 该溶液能与NaOH溶液发生中和反应 | |
| D. | 若该溶液显酸性,则K1•K2>10-14 |
分析 A.弱酸的酸式盐在溶液中电离出金属离子和酸式酸根离子;
B.若HXOn-的水解程度大于电离程度,在溶液中以水解为主,会促进水的电离;
C.酸式盐能与NaOH溶液反应生成正盐和水;
D.KHXOn溶液显酸性,说明电离程度大于水解程度,根据电离常数与水解常数的关系分析.
解答 解:A.弱酸的酸式盐在溶液中电离出金属离子和酸式酸根离子,则KHXOn的电离方程式为KHXOn═K++HXOn-,故A错误;
B.若HXOn-的水解程度大于电离程度,在溶液中以水解为主,会促进水的电离,所以不能确定KHXOn溶液中水的电离程度是变大还是变小,故B错误;
C.酸式盐能与NaOH溶液反应生成正盐和水,但是该反应不是中和反应,故C错误;
D.KHXOn溶液显酸性,说明电离程度大于水解程度,即K2>Kh,已知K1×Kh=Kw=10-14,所以K1•K2>10-14,故D正确.
故选D.
点评 本题考查了弱电解质的电离和盐的水解,题目难度中等,注意把握电离常数与水解常数之间的关系,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
1.化学与生产、生活、社会密切相关,下列有关说法中正确的是( )
| A. | 苯酚有一定毒性,不能作消毒剂和防腐剂 | |
| B. | 纤维素可水解成葡萄糖,人类可从中获得生存所需的能量 | |
| C. | 2014年1月,国家首次将雾霾天气纳入自然灾情进行通报,雾霾是一种不同于胶体的分散系,它的形成与大量焚烧田间秸秆有关 | |
| D. | 煤经气化和液化两个物理变化过程,可变为清洁能源 |
18.如表为元素周期表的一部分,X、Y、Z、W为短周期元素,其中X元素的原子最外层电子数是其内层电子数的2倍,下列说法正确的是( )
| X | Y | ||
| Z | W | ||
| T |
| A. | 根据元素周期律,可以推测存在T3Y4、TZ2和TW4 | |
| B. | X氢化物的沸点一定比Y氢化物的沸点低 | |
| C. | XZ2、XW4与YW3都是非极性分子 | |
| D. | W的氧化物的水化物酸性一定比Z的强 |
5.《化学反应原理》一书中,我们学习了两个重要的定量实验.请回答下列问题:
Ⅰ、某化学兴趣小组要完成中和热的测定.
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、5mol?L-1 盐酸、0.55mol?L-1NaOH溶液,尚缺少的实验玻璃用品是量筒、温度计.
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?否(填“能”或“否”),其原因是金属易导热,热量散失导致误差大.
(3)他们记录的实验数据如下:
已知:Q(放)=C m(t2-t1),反应后溶液的比热容C为4.18KJ?℃-1?Kg-1,m指溶液的质量,各物质的密度均为1g?cm-3.
①计算分析△H=-56.8KJ/mol.(结果保留3位有效数字)
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-56.8KJ/mol.
Ⅱ、为了测定含有H2C2O4•2H2O、KHC2O4和K2SO4的试样中各物质的质量分数,进行如下实验:
①称取6.0g试样,加水溶解,配成250mL试样溶液.
②用酸式滴定管量取25.00mL试样溶液放入锥形瓶中,并加入2~3滴酚酞试液,用0.2500mol/L NaOH溶液滴定,消耗NaOH溶液20.00mL.
③再取25.00mL试样溶液放入另一锥形瓶中,用0.1000mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液16.00mL.
回答下列问题:
(1)已知:0.10mol/L KHC2O4溶液pH约为3,其中含碳元素的粒子浓度由大到小的顺序为c(HC2O4-)>c(C2O42-)>c(H2C2O4).
(2)完成并配平下列离子方程式
5C2O42-+2MnO4-+16H+=10CO2+2Mn2++8H2O.
(3)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的H2C2O4•2H2O的质量分数偏小.(填“偏大”、“偏小”或“无影响”)
(4)步骤③中判断滴定终点的方法是滴入最后一滴溶液呈紫红色且半分钟颜色不变.
(5)常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示:
(i)写出H2C2O4的电离方程式H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-.
(ii)KHC2O4溶液显酸性的原因是 (请用方程式并结合必要的文字回答该小题)HC2O4-?H++C2O42-,HC2O4-+H2O?H2C2O4+OH-,但其电离程度大于水解程.
(iii)向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是ad.
a.c(K+)═c(HC2O4-)+c(H2C2O4)+c(C2O42- ) b.c(Na+)═c(H2C2O4)+c(C2O42-)
c.c(K+)+c(Na+)═c(HC2O4-)+c(C2O42- ) d.c(K+)>c(Na+)
Ⅰ、某化学兴趣小组要完成中和热的测定.
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、5mol?L-1 盐酸、0.55mol?L-1NaOH溶液,尚缺少的实验玻璃用品是量筒、温度计.
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?否(填“能”或“否”),其原因是金属易导热,热量散失导致误差大.
(3)他们记录的实验数据如下:
| 实 验 试剂如下: | 溶 液 温 度 | 中和热△H | ||||
| t1 | t2 | |||||
| ① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.3℃ | ||
| ② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | ||
①计算分析△H=-56.8KJ/mol.(结果保留3位有效数字)
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-56.8KJ/mol.
Ⅱ、为了测定含有H2C2O4•2H2O、KHC2O4和K2SO4的试样中各物质的质量分数,进行如下实验:
①称取6.0g试样,加水溶解,配成250mL试样溶液.
②用酸式滴定管量取25.00mL试样溶液放入锥形瓶中,并加入2~3滴酚酞试液,用0.2500mol/L NaOH溶液滴定,消耗NaOH溶液20.00mL.
③再取25.00mL试样溶液放入另一锥形瓶中,用0.1000mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液16.00mL.
回答下列问题:
(1)已知:0.10mol/L KHC2O4溶液pH约为3,其中含碳元素的粒子浓度由大到小的顺序为c(HC2O4-)>c(C2O42-)>c(H2C2O4).
(2)完成并配平下列离子方程式
5C2O42-+2MnO4-+16H+=10CO2+2Mn2++8H2O.
(3)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的H2C2O4•2H2O的质量分数偏小.(填“偏大”、“偏小”或“无影响”)
(4)步骤③中判断滴定终点的方法是滴入最后一滴溶液呈紫红色且半分钟颜色不变.
(5)常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示:
| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.1 | 3.1 | 8.1 |
(ii)KHC2O4溶液显酸性的原因是 (请用方程式并结合必要的文字回答该小题)HC2O4-?H++C2O42-,HC2O4-+H2O?H2C2O4+OH-,但其电离程度大于水解程.
(iii)向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是ad.
a.c(K+)═c(HC2O4-)+c(H2C2O4)+c(C2O42- ) b.c(Na+)═c(H2C2O4)+c(C2O42-)
c.c(K+)+c(Na+)═c(HC2O4-)+c(C2O42- ) d.c(K+)>c(Na+)
6.下列有关同分异构体数目的叙述中,正确的是( )
| A. | 甲苯苯环上的一个氢原子被含 4 个碳原子的烷基取代,所得产物有12种 | |
| B. | 等物质的量的氯气与乙烷在光照条件下反应得到10种产物 | |
| C. | 已知二氯苯有3种同分异构体,则四氯苯的同分异构体的数目为6种 | |
| D. | 苯乙烯和氢气完全加成的产物的一溴取代物有5种 |
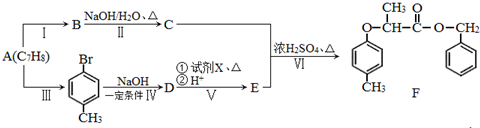

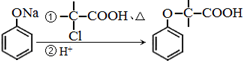
 +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$  +NaCl.
+NaCl. .
. 为原料制取
为原料制取 的合成路线图.
的合成路线图.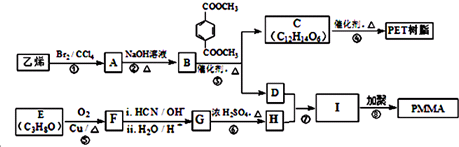
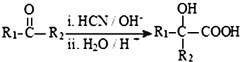 (R、R1、R2、R3均代表烃基)
(R、R1、R2、R3均代表烃基)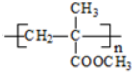 .
.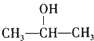 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2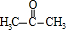 +2H2O.
+2H2O.