题目内容
18.(1)下列物质中,属于弱电解质的是(填序号,下同)①⑦,属于非电解质是④⑥.①冰醋酸 ②次氯酸钠 ③氯水 ④二氧化碳 ⑤硫酸氢钠⑥蔗糖 ⑦氢氧化铝 ⑧铜
(2)写出下列物质在水中的电离方程式:
硫酸氢钠(NaHSO4):NaHSO4═Na++H++SO42-;氯化镁(MgCl2):MgCl2=Mg2++2Cl-;
(3)甲、乙两瓶氨水的浓度分别为1mol•L-1、0.1mol•L-1,则c(OH-)甲:c(OH-)乙小于 10(填“大于”、“等于”或“小于”).
(4)现有常温条件下甲、乙、丙三种溶液,甲为0.1mol•L-1的NaOH溶液,乙为0.1mol/L的HCl溶液,丙为0.1mol/L的CH3COOH溶液,甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为丙>甲=乙;
(5)NO2与NO之间存在如下可逆反应:2NO2?2NO+O2.T℃时,在一恒容密闭容器中充入适量NO2,反应达到平衡状态的标志是①③④
①混合气体的颜色不再改变的状态
②混合气体的密度不再改变的状态
③混合气体的压强不再改变的状态
④$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)•c({O}_{2})}$的比值不再改变的状态.
分析 (1)电解质:在水溶液中或熔融状态下能够导电的化合物;非电解质:在熔融状态和水溶液中都不能导电的化合物;在水溶液中完全电离的是强电解质;部分电离的是弱电解质;
(2)先判断强弱电解质,强电解质完全电离,电离方程式用等号,弱电解质部分电离,电离方程式用可逆号,据此进行解答;
(3)弱电解质溶液中,弱电解质的浓度越大,其电离程度越小,浓度越小,其电离程度越大;
(4)酸或碱抑制水电离,含有弱根离子的盐促进水电离;
(5)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的物理量不变,据此分析解答.
解答 解:(1)①冰醋酸在水溶液中部分电离,是弱电解质;
②次氯酸钠在水溶液中或熔融状态下能够导电,是电解质,在水中完全电离属于强电解质;
③氯水是混合物不是电解质;
④二氧化碳在熔融状态和水溶液中都不能导电,是非电解质;
⑤硫酸氢钠溶于水完全电离,是强电解质;
⑥蔗糖在熔融状态和水溶液中都不能导电,是非电解质;
⑦氢氧化铝在水溶液中部分电离,是弱电解质;
⑧Cu是单质不是电解质,也不是非电解质;
故答案为:①⑦;④⑥;
(2)NaHSO4为强电解质,在溶液中完全电离,其电离方程式为:NaHSO4═Na++H++SO42-;
MgCl2在溶液中完全电离出镁离子和氯离子,其电离方程式为:MgCl2=Mg2++2Cl-;
故答案为:NaHSO4═Na++H++SO42-;MgCl2=Mg2++2Cl-;
(3)一水合氨是弱电解质,在溶液里存在电离平衡,氨水的浓度越大,一水合氨的电离程度越小,浓度越小,一水合氨的电离程度越大,
甲瓶氨水的浓度是乙瓶氨水的浓度的10倍,由弱电解质的浓度越小,电离程度越大,故甲瓶氨水的电离度比乙瓶氨水的电离度小,
所以甲、乙两瓶氨水中[OH-]之比小于10,
故答案为:小于;
(4)酸或碱抑制水电离,含有弱根离子的盐促进水电离,乙酸是弱电解质,氢氧化钠、氯化氢是强电解质,所以相同物质的量浓度的乙酸和盐酸和氢氧化钠,盐酸中水电离出的氢氧根离子浓度小于醋酸,相同物质的量浓度的盐酸和氢氧化钠对水电离抑制程度相等,盐酸中水电离出的氢氧根离子浓度等于氢氧化钠溶液中水的电离,所以水电离出氢氧根离子浓度大小顺序是:丙>甲=乙,
故答案为:丙>甲=乙;
(5)①混合气体的颜色不再改变时,各物质的浓度不变,说明该反应达到平衡状态,所以可以据此判断平衡状态,故正确;
②该反应的反应前后气体质量不变、容器体积不变,所以无论该反应是否达到平衡状态,反应体系的密度始终不变,所以不能据此判断平衡状态,故错误;
③该反应的反应前后是气体体积增大的可逆反应,当反应达到平衡状态时,各物质浓度不变,所以混合气体的压强不再改变,所以可以据此判断平衡状态,故正确;
④该反应的反应前后有热量变化,当该反应达到平衡状态时,反应体系温度不再发生变化,所以$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)•c({O}_{2})}$不再变化,则可以据此判断平衡状态,故正确.
故答案为:①③④.
点评 本题考查了弱电解质的电离和盐类的水解、化学平衡状态的判断等知识,题目难度中等.答题时注意审题.注意掌握溶液酸碱性与溶液pH的关系结以及平衡状态的判断方法是解答本题关键.

 阅读快车系列答案
阅读快车系列答案| A. | 肯定有SO2 和NO | B. | 肯定有SO2和NO2 | ||
| C. | 可能有Cl2、NO和O2 | D. | 肯定有SO2、NO和O2 |
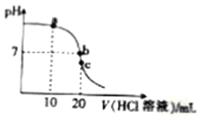
| A. | a点对应的溶液中,c(Cl-)>c(NH4+ )>c(OH- )>c(H+ ) | |
| B. | b点对应的溶液中,c(NH4+)>c(Cl-),c(OH- )=c(H+ ) | |
| C. | c点对应的溶液中,c(H+)=c(NH3•H2O)+c(OH- ) | |
| D. | 滴定过程中可能出现:c(NH4+ )>c(OH- )>c(H+ )>c(Cl-) |
| A. | 滴加KI溶液时,CuI是还原产物,KI被还原 | |
| B. | 通入SO2后,溶液变无色,体现SO2的漂白性 | |
| C. | 整个过程发生了复分解反应和氧化还原反应 | |
| D. | 上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
| A. | 甲烷 | B. | 乙烷 | C. | 丙烷 | D. | 丁烷 |
| A. | 向pH相同的氨水和氢氧化钠溶液中分别加入适量NH4Cl(s)后,两溶液的pH均减小 | |
| B. | 将Ca(OH)2的饱和溶液加热,pH 和 Ksp均增大 | |
| C. | 25℃时pH=11的NaOH,当温度升高到80℃时,其pH不变 | |
| D. | 用CH3COOH 溶液做导电性实验,灯泡很暗,能证明CH3COOH 是弱电解质 |
| A. | 碱性氧化物一定是金属氧化物,金属氧化物一定是碱性氧化物 | |
| B. | 由一种元素组成的物质一定是单质,两种元素组成的物质一定是化合物 | |
| C. | 非金属氧化物不一定是酸性氧化物,酸性氧化物不一定都是非金属氧化物 | |
| D. | 硫酸、纯碱、石膏是按酸、碱、盐排列的 |
| A. | Ba(OH)2溶液中加入少量NaHSO4:OH-+H+═H2O | |
| B. | 钠加入水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | NaOH溶液中通入足量的CO2:OH-+CO2═HCO3- | |
| D. | Al2(SO4)3溶液中加入足量Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |