题目内容
15.设NA为阿伏加德罗常数,下列对于0.3mol/L硫酸钾溶液的说法不正确的是( )| A. | 1 L溶液中含有0.6 NA个钾离子 | |
| B. | 1 L溶液中含有钾离子和硫酸根离子总数为0.9 NA | |
| C. | 2 L溶液中钾离子浓度为1.2 mol/L | |
| D. | 2 L溶液中含有硫酸根离子0.6 NA个 |
分析 A、求出硫酸钾的物质的量n=CV,然后根据1mol硫酸钾中含2mol钾离子来分析;
B、求出硫酸钾的物质的量n=CV,然后根据1mol硫酸钾中含2mol钾离子和1mol硫酸根来分析;
C、根据硫酸钾的化学式K2SO4可知,钾离子的浓度是硫酸根浓度的2倍;
D、求出硫酸钾的物质的量n=CV,然后根据1mol硫酸钾中1mol硫酸根来分析.
解答 解:A、1L溶液中硫酸钾的物质的量n=CV=1L×0.3mol/L=0.3mol,而1mol硫酸钾中含2mol钾离子,故0.3mol硫酸钾中含0.6NA个钾离子,故A正确;
B、1L溶液中硫酸钾的物质的量n=CV=1L×0.3mol/L=0.3mol,而1mol硫酸钾中含2mol钾离子和1mol硫酸根即含3mol离子,故0.3mol硫酸钾溶液中含0.9NA个离子,故B正确;
C、根据硫酸钾的化学式K2SO4可知,钾离子的浓度是硫酸根浓度的2倍,故钾离子的浓度为0.6mol/L,与溶液体积为2L无关,故C错误;
D、2L溶液中含有的硫酸钾的物质的量n=CV=2L×0.3mol/L=0.6mol,而1mol硫酸钾中1mol硫酸根,故0.6mol硫酸钾中含0.6NA个硫酸根,故D正确.
故选C.
点评 本题考查了溶液中溶质的物质的量、微粒个数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
6.氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等.下列反应与Br2+SO2+2H2O═H2SO4+2HBr相比较,水的作用相同的是( )
| A. | 3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | 2H2O2═2H2O+O2↑ | D. | 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ |
3.以下几个热化学方程式,表示碳或氢气燃耗热的热化学方程式是( )
| A. | C(s)+O2(g)═CO(g)△H=110.5 kJ/mol | |
| B. | C(s)+O2(g)═CO2(g)△H=-393.5 kJ/mol | |
| C. | 2H2(g)+O2(g)═2 H2O(l)△H=-571.6 kJ/mol | |
| D. | H2(g)+O2(g)═H2O(g)△H=-241.8 kJ/mol |
10.钠、鉄、铝与足量的盐酸反应,若产生相同物质的量的氢气,所需钠、鉄、铝的质量比是( )
| A. | 1:2:3 | B. | 23:28:9 | C. | 6:3:2 | D. | 28:23:9 |
20.关于乙醇结构方面的说法中正确的是( )
| A. | 乙醇结构中有-OH,所以乙醇溶解于水,可以电离出OH-而显碱性 | |
| B. | 乙醇与乙酸反应生成乙酸乙酯,所以乙醇显碱性 | |
| C. | 乙醇与钠反应可以产生氢气,所以乙醇显酸性 | |
| D. | 乙醇与钠反应时,乙醇羟基上的氢原子被置换 |
7.下列关于金属元素的说法中,正确的是( )
| A. | 金属原子的最外层电子数一定不大于4 | |
| B. | 黑色金属只包括铁、铬、锰 | |
| C. | 金属氧化物一定是碱性氧化物 | |
| D. | 金属元素既有正化合价又有负价 |
5.分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可以采取多种分类方法.下列关于KMnO4的分类不正确的是( )
| A. | 化合物 | B. | 氧化物 | C. | 无机物 | D. | 钾盐 |
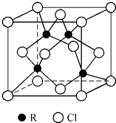 物质的组成、结构都是决定物质性质的重要因素.
物质的组成、结构都是决定物质性质的重要因素.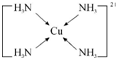 ,其中配体分子中心原子的杂化方式为sp3,与外界离子互为等电子体的一种分子的化学式为SiCl4或SiF4.
,其中配体分子中心原子的杂化方式为sp3,与外界离子互为等电子体的一种分子的化学式为SiCl4或SiF4.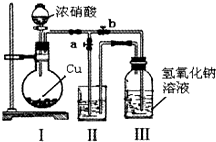 针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动: