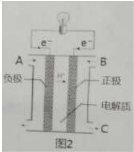
题目内容
W、X、Y、Z是短周期元素,其部分性质如表,下列说法正确的是( )
| W | 单质是淡黄色固体 | ||
| X | 在地壳中的含量居第二位 | ||
| Y | 原子最外层电子数是电子总数的
| ||
| Z | 第三周期原子半径最小的金属 |
| A、气态氢化物的热稳定性:X<W |
| B、最高价氧化物对应水化物的酸性:Y>X |
| C、离子半径:Z>W |
| D、Y的氧化物中含有非极性共价键 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:W、X、Y、Z是短周期元素,W单质是淡黄色固体,则W为S;X在地壳中的含量居第二位,则X为Si;Y原子最外层电子数是电子总数的
,若Y处于第二周期,令最外层电子数为a,则(2+a)×
=a,解得a=4,为碳元素,若Y处于第三周期,令最外层电子数为a,则(2+8+a)×
=a,解得a=20,不符合题意,故Y为碳元素;Z是第三周期原子半径最小的金属,则Z为Al,结合元素周期律与元素化合物性质解答.
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
解答:
解:W、X、Y、Z是短周期元素,W单质是淡黄色固体,则W为S;X在地壳中的含量居第二位,则X为Si;Y原子最外层电子数是电子总数的
,若Y处于第二周期,令最外层电子数为a,则(2+a)×
=a,解得a=4,为碳元素,若Y处于第三周期,令最外层电子数为a,则(2+8+a)×
=a,解得a=20,不符合题意,故Y为碳元素;Z是第三周期原子半径最小的金属,则Z为Al,
A.非金属性S>Si,故氢化物稳定性H2S>SiH4,故A正确;
B.X为Si、Y为C,非金属性C>Si,故最高价氧化物对应水化物的酸性:Y>X,故B正确;
C.S2-离子比Al3+多一个电子层,故离子半径S2->Al3+,故C错误;
D.碳的氧化物中不含非极性键,故D错误,
故选AB.
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
A.非金属性S>Si,故氢化物稳定性H2S>SiH4,故A正确;
B.X为Si、Y为C,非金属性C>Si,故最高价氧化物对应水化物的酸性:Y>X,故B正确;
C.S2-离子比Al3+多一个电子层,故离子半径S2->Al3+,故C错误;
D.碳的氧化物中不含非极性键,故D错误,
故选AB.
点评:本题考查结构性质位置关系应用,推断元素是解题关键,注意对元素周期律的理解掌握,难度中等.

练习册系列答案
相关题目
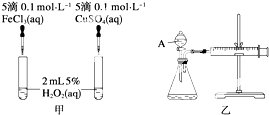 为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )
为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )| A、图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小 |
| B、若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 |
| C、用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间 |
| D、为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 |
下列关于物质分离的实验说法正确的是( )
| A、用过滤的方法得到食盐水中的NaCl |
| B、用蒸发的方法从碳酸钙的悬浊液总提取碳酸钙 |
| C、用蒸发的方法得到海水中的水 |
| D、对医用酒精进行蒸馏操作可以得到更高纯度的酒精溶液 |
把3.0mol M和2.5mol N混合于2.0L的恒容密闭容器中,发生反应3M(g)+N(g)?xP(g)+2Q(g),5min反应达到平衡,已知M的转化率为50%,P的反应速率为0.15mol?L-1?min-1,则下列说法正确的是( )
| A、方程式中x=2 |
| B、达平衡后,容器内压强是反应起始时的2倍 |
| C、向容器中再充入3.0 mol M和2.5 mol N,达新平衡时Q的体积分数减小 |
| D、容器内混合气体的密度不再变化和平均相对分子质量不再变化均可作为达到平衡状态的标志 |
下列实验推理中,正确的是( )
| A、实验时剩余的药品不能放回原瓶,所以实验时剩余的金属钠也不能放回原瓶 |
| B、某种气体通入品红溶液中,品红褪色,该气体一定是SO2 |
| C、焰色反应时观察到黄色火焰,说明样品中一定含钠元素可能含钾元素 |
| D、将铜片放入浓硫酸中,无明显现象,说明铜在冷浓硫酸中发生钝化 |
 (1)NaClO溶液在碱性条件下将CN-氧化成无毒的碳酸根离子和N2,该反应离子方程式
(1)NaClO溶液在碱性条件下将CN-氧化成无毒的碳酸根离子和N2,该反应离子方程式