题目内容
已知:Fe(s)+
O2(g)=FeO(s)△H1=-272.0KJ/mol;
2Al(s)+
O2(g)=Al2O3(s)△H2=-1675.7KJ/mol.
则Al与FeO发生铝热反应的热化学方程式为 ;某同学认为,铝热反应可用于工业炼铁,你的判断是 (填“能”或“不能”),理由是 .
| 1 |
| 2 |
2Al(s)+
| 3 |
| 2 |
则Al与FeO发生铝热反应的热化学方程式为
考点:反应热和焓变,热化学方程式
专题:化学反应中的能量变化
分析:依据题干热化学方程式结合盖斯定律写出该热化学反应方程式,利用铝热反应大量制取金属时考虑经济效益,有没有更好的方法.
解答:
解:①Fe(s)+
O2(g)=FeO(s)△H=-272.0kJ?mol-1
②2Al(s)+
O2(g)=Al2O3(s)△H=-1675.7kJ?mol-1
将方程式②-①×3得2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ?mol-1,
利用铝热反应在工业上大面积炼铁时,需要消耗冶炼成本更高的Al,冶炼Fe的成本就太高了,
故答案为:2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ?mol-1;不能;成本太高,无经济利益.
| 1 |
| 2 |
②2Al(s)+
| 3 |
| 2 |
将方程式②-①×3得2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ?mol-1,
利用铝热反应在工业上大面积炼铁时,需要消耗冶炼成本更高的Al,冶炼Fe的成本就太高了,
故答案为:2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ?mol-1;不能;成本太高,无经济利益.
点评:本题考查了盖斯定律的应用、工业生产的成本核算,需联系实际解决问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
计算:
(1)在0.5molH2O中,所含有分子数 ,原子数 ,电子数 .
(2)标准状况下:5.6LO2的物质的量是 ,质量是 .
(3)将58.5g的NaCl配制成2L溶液,该溶液的物质的量的浓度为 .
(1)在0.5molH2O中,所含有分子数
(2)标准状况下:5.6LO2的物质的量是
(3)将58.5g的NaCl配制成2L溶液,该溶液的物质的量的浓度为
丹参酮是中草药丹参的有效成分,结构如图: 关于丹参酮的叙述正确的是( )
关于丹参酮的叙述正确的是( )
 关于丹参酮的叙述正确的是( )
关于丹参酮的叙述正确的是( )| A、属于芳香烃 | B、属于烃的衍生物 |
| C、属于酯 | D、属于醛 |
 有机化学中有如下的转化关系:C2H4→CH3CH2OH→CH3CHO→CH3COOH
有机化学中有如下的转化关系:C2H4→CH3CH2OH→CH3CHO→CH3COOH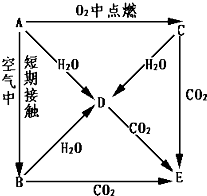 A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A金属为单质.
A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A金属为单质.