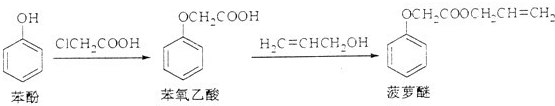
题目内容
下列说法或表示方法正确的是( )
| A、等物质的量的硫蒸汽和硫固体分别完全燃烧,前者放出热量少 |
| B、由C(石墨)═C(金刚石)△H=+1.90kJ?mol-1可知,金刚石没有石墨稳定 |
| C、在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l);△H=-285.8kJ?mol-1 |
| D、在稀溶液中,H+(aq)+OH-(aq)═H2O(1);△H=-57.3kJ?mol-1,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量小于57.3kJ |
考点:反应热和焓变,热化学方程式
专题:化学反应中的能量变化
分析:A、硫蒸汽所含能量比硫固体高;
B、能量越低越稳定;
C、2g氢气是1mol,注意热化学方程式的化学计量数;
D、浓硫酸溶于水放热.
B、能量越低越稳定;
C、2g氢气是1mol,注意热化学方程式的化学计量数;
D、浓硫酸溶于水放热.
解答:
解:A、硫蒸汽所含能量比硫固体高,所以,等物质的量的硫蒸汽和硫固体分别完全燃烧,前者放出热量多,故A错误;
B、从热化学方程式看,石墨能量低,物质所含能量越低越稳定,故B正确;
C、2g氢气是1mol,热化学方程式应为:2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ?mol-1,故C错误;
D、浓硫酸溶解时放热,所以,将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ,故D错误.
故选:B
B、从热化学方程式看,石墨能量低,物质所含能量越低越稳定,故B正确;
C、2g氢气是1mol,热化学方程式应为:2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ?mol-1,故C错误;
D、浓硫酸溶解时放热,所以,将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ,故D错误.
故选:B
点评:本题注意:
1、物质的三态变化与能量的关系;
2、物质的能量越低越稳定;
3、热化学方程式书写中,化学计量数与△H数值的对应;
4、中和热是指强酸强碱的稀溶液中和.
1、物质的三态变化与能量的关系;
2、物质的能量越低越稳定;
3、热化学方程式书写中,化学计量数与△H数值的对应;
4、中和热是指强酸强碱的稀溶液中和.

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
下列各组物质的性质排序正确的是( )
| A、酸性:H3PO4>H2SO4>HClO4 |
| B、水溶性:NH3>CO2>SO2>H2S |
| C、热稳定性:HF>H2O>NH3 |
| D、沸点:新戊烷>正戊烷>丁烷 |
羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得.
下列有关说法不正确的是( )

下列有关说法不正确的是( )
| A、该反应是加成反应 |
| B、上述反应的原子利用率可达到100% |
| C、乙醛酸与H2在热的镍催化下反应生成乙二醇 |
| D、对羟基扁桃酸可以发生加成反应、取代反应和缩聚反应 |
在100mL 0.5mol/L的AlCl3溶液中加入100mLNaOH溶液,得到0.01mol Al(OH)3沉淀,则NaOH溶液的物质的量浓度可能为( )
| A、0.6 mol/L |
| B、1.6 mol/L |
| C、1.9 mol/L |
| D、2.2 mol/L |
在元素周期表中,在金属元素和非金属元素分界线附近能找到什么材料( )
| A、催化剂 | B、半导体 |
| C、农药 | D、制冷剂 |
下列说法不正确的是( )
| A、不是所有的共价键(σ键)都具有方向性 |
| B、N≡N键能比N=N与N-N的键能和大,所以N≡N不易发生加成反应 |
| C、根据电负性及价层电子对互斥理论可知,OF2分子的极性小于H2O分子的极性 |
| D、基态Na原子核外电子占有3个能层、4种能级、6个原子轨道、6种电子运动状态 |

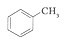 和
和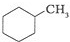 .其中互为同分异构体的是
.其中互为同分异构体的是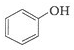 )、乙醛(CH3CHO)、乙酸(CH3COOH)、乙醇(CH3CH2OH).
)、乙醛(CH3CHO)、乙酸(CH3COOH)、乙醇(CH3CH2OH).