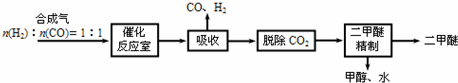
��Ŀ����
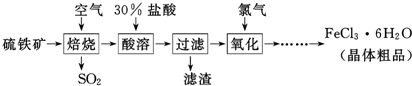
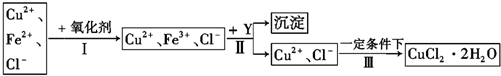
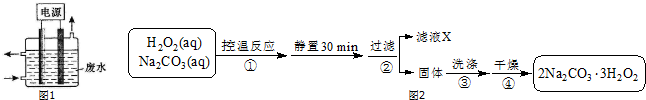
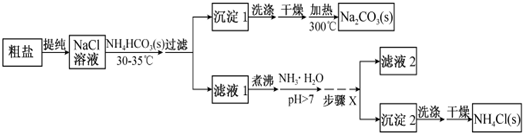
8��ij�о���ѧϰС�����ȷֽ�CuCl2•2H2O�Ʊ�CuCl�����������̽���������ϲ��ġ�
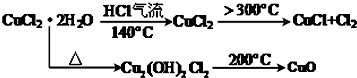
��ʵ��̽������С������ͼ��ʾװ�ý���ʵ�飨�г������ԣ���
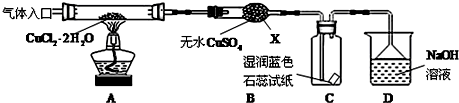
��ش��������⣺
��1������X�����������θ���ܣ�
��2��ʵ��������Ⱥ�˳����a��c-d-b_��e��������ı�ţ�
a�����װ�õ������Ժ����ҩƷ b��Ϩ��ƾ��ƣ���ȴ
c���ڡ�������ڡ�������HCl d����ȼ�ƾ��ƣ�����
e��ֹͣͨ��HCl��Ȼ��ͨ��N2
��3����ʵ������У��۲쵽B�������ɰ�ɫ��Ϊ��ɫ��C����ֽ����ɫ�仯��ʯ����ֽ����Ϊ��ɫ������ɫ
��4��װ��D�з�����������ԭ��Ӧ�����ӷ���ʽ��Cl2+2OH-=Cl-+ClO-+H2O��
��5����Ӧ������ȡ��CuCl��Ʒ����ʵ�飬�������к���������CuO���ʣ�����������Ϣ�������������ԭ����ͨ��HCl�������㣮
���� �ȷֽ�CuCl2•2H2O�Ʊ�CuCl��Ϊ����ˮ�⣬�������ͨ��HCl���壬Ȼ�����A���Թܣ�XΪ���θ���ܣ�X����ˮ����ͭ��������֪CuCl2•2H2O�ֽ�����ˮ����C����ֽ�ȱ�����ɫ����֪����2CuCl2$\frac{\underline{\;����300��\;}}{\;}$2CuCl+Cl2����D��NaOH��Һ����β����ȡ��CuCl��Ʒ����ʵ�飬�������к���������CuO���ʣ�����CuO��û����HCl�ķ�Χ�м��Ȼ���δ���Թ���ȴ��ֹͣͨ��HCl�����йأ��Դ������
��� �⣺��1����ͼ��������������֪������X������Ϊ���θ���ܣ��ʴ�Ϊ�����θ���ܣ�
��2��ʵ�������������ɣ��ȼ���װ�õ������ԣ����ȷֽ�CuCl2•2H2O�Ʊ�CuCl����ֹCuCl��������Cu+ˮ�����Ա���Ҫ�ȸ���װ���е�������ˮ������ż��ȣ���Ҫ��HCl�����м����Ʊ�����Ӧ��������Ϩ��ƾ��ƣ�Ӧ��Ҫ����ͨ�뵪��ֱ��װ�����У����Բ���˳��Ϊ��a-c-d-b-e��
�ʴ�Ϊ��c-d-b��
��3��B���а�ɫ��Ϊ��ɫ��˵����ˮ���ɣ������л���Cl2������C��ʯ����ֽ����Ϊ��ɫ������ɫ��
�ʴ�Ϊ��ʯ����ֽ����Ϊ��ɫ������ɫ��
��4��D����Cl2��NaOH��Ӧ�����Ȼ��ơ��������ƺ�ˮ����Ӧ�����ӷ���ʽΪCl2+2OH-=Cl-+ClO-+H2O��
�ʴ�Ϊ��Cl2+2OH-=Cl-+ClO-+H2O��
��5����2CuCl2$\frac{\underline{\;����300��\;}}{\;}$2CuCl+Cl2��������������ͭ��˵��CuCl�����������Ų�����CuO��˵��װ������������������û����HCl�ķ�Χ�м��Ȼ���δ���Թ���ȴ��ֹͣͨ��HCl���壬�ʴ�Ϊ��ͨ��HCl�������㣮
���� ���⿼�����ʵ��Ʊ�ʵ�飬Ϊ��Ƶ���㣬�����Ʊ�ʵ��ԭ����ʵ��װ�õ����á�Ԫ�ػ�����֪ʶΪ���Ĺؼ������ط�����ʵ�������Ŀ��飬ע��Ԫ�ػ�������ʵ�����ϵ�ѵ������5��Ϊ�����ѵ㣬��Ŀ�Ѷ��еȣ�

 ������ҵ��ͬ����ϰ��ϵ�д�
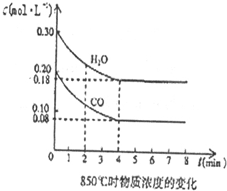
������ҵ��ͬ����ϰ��ϵ�д�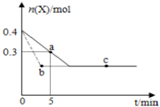 �ں���2L�ܱ�������ͨ������X��������Ӧ��2X��g���TY��g����H��0��X�����ʵ���n��x����ʱ��t�仯��������ͼ��ʾ��ͼ�е������߷ֱ���������������Σ�������������ȷ���ǣ�������
�ں���2L�ܱ�������ͨ������X��������Ӧ��2X��g���TY��g����H��0��X�����ʵ���n��x����ʱ��t�仯��������ͼ��ʾ��ͼ�е������߷ֱ���������������Σ�������������ȷ���ǣ�������| A�� | ʵ�߱�ʾʹ�ô��������� | |
| B�� | b��c���������Ӧ����Ӧ�����´ﵽ������� | |
| C�� | ��Ӧ�ӿ�ʼ��a���ƽ����Ӧ���ʿɱ�ʾΪv��Y��=0.01mol/��L•min�� | |
| D�� | ��Ӧ���е�a��ʱ�ų����������ڷ�Ӧ���е�b��ʱ�ų������� |
 ���ǵ����Ϻ����Ϸḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ�������ճ�������������Ҫ���ã�
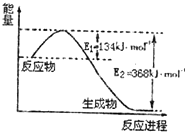
���ǵ����Ϻ����Ϸḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ�������ճ�������������Ҫ���ã���1��ͼ��1mol NO2��g����1mol CO��g����Ӧ����CO2��g����NO��g�������������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽNO2��g��+CO��g��=CO2��g��+NO��g����H=-234kJ•mol-1��
��2����һ��������ܱ������У��������»�ѧ��Ӧ��N2��g��+3H2��g��?2NH3��g����H��0
�仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ�����
| t/�� | 25 | 125 | 225 | �� |
| K/��mol•L-1��-2 | 4.1��106 | K1 | K2 | �� |
�ٱȽ�K1��K2�Ĵ�С��K1��K2�����������=����������
���жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������AC������ţ���
A��2vH2������=3vNH3���棩
B��3vNH3������=2vH2������
C��������ѹǿ���ֲ���
D�����������ܶȱ��ֲ��䣮
| A�� | �����������ڴ�л�����ղ��������� | |
| B�� | ���յ�����û���������� | |
| C�� | ��ʳ�ؽ����λ�ʹ���ж���Ӧ������ţ�̡������ⶾ | |
| D�� | ���Ȼ�ʹ�����ʱ��ԣ�������Լ�������Ժ� |