题目内容
12.处于同一短周期的A、B、C、D四种主族元素,其中 A的原子半径最小; B元素基态原子的最外层有3个未成对电子,次外层有2个电子;C的电负性介于A、B之间;D与B相邻.请填空:(1)已知B元素形成单质分子的电子式为
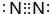 ;
;(2)在A、B、C、D四种元素形成的电子数相同的四种氢化物中,沸点最低的是CH4(写分子式,下同);稳定性最强的是HF;为非极性分子的是CH4.B、C、D三种元素形成氢化物中B、C、D三种元素原子轨道的杂化类型是否相同是(填“是”或“否”).
(3)B、C、D中第一电离能由大到小的顺序是N>O>C(写元素符号)
(4)A的氢化物易溶于水,原因是HF与H2O均为极性分子,相似相溶,HF与H2O之间形成氢键_.
分析 处于同一短周期的A、B、C、D四种主族元素,B元素基态原子的最外层有3个未成对电子,次外层有2个电子,则B原子核外电子排布式为1s22s22p3,故B为N元素;A的原子半径最小,则A为F元素;C的电负性介于F、N之间,则C为O元素;D与B相邻,则D为碳元素,据此解答.
解答 解:处于同一短周期的A、B、C、D四种主族元素,B元素基态原子的最外层有3个未成对电子,次外层有2个电子,则B原子核外电子排布式为1s22s22p3,故B为N元素;A的原子半径最小,则A为F元素;C的电负性介于F、N之间,则C为O元素;D与B相邻,则D为碳元素.
(1)B元素形成单质分子为N2,电子式为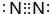 ,故答案为:
,故答案为: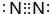 ;
;
(2)A、B、C、D四种元素形成的电子数相同的四种氢化物为HF、NH3、H2O、CH4,前三种分子之间均含有氢键,甲烷分子之间为范德华力,故沸点最低的是CH4,F元素非金属性最强,故稳定性最强的是 HF,甲烷为正四面体对称结构,为非极性分子,其它三种为极性分子,NH3、H2O、CH4中心原子的杂化轨道数目均为4,中心原子均为sp3杂化,
故答案为:CH4;HF;CH4;是;
(3)同周期随原子序数增大,元素第一电离能呈增大趋势,但氮元素2p能级为半满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能N>O>C,
故答案为:N>O>C;
(4)HF与H2O均为极性分子,相似相溶,HF与H2O之间形成氢键,故HF易溶于水,
故答案为:HF与H2O均为极性分子,相似相溶,HF与H2O之间形成氢键.
点评 本题考查结构性质位置关系应用、元素周期律、分子结构与性质等,注意同周期主族元素第一电离能异常情况.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目
20.下列有机反应属于取代反应的是( )
| A. | nCH2═CH2-→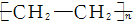 | B. | CH2═CH2+HCl-→CH3CH2Cl | ||
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH2CHO+2H2O | D. | 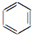 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$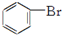 +HBr +HBr |
7.某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种组成.取该溶液进行如下实验:
(1)取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液;
(2)在(1)所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀甲;
(3)在(2)所得溶液中加入过量Ba(OH)2溶液也有气体生成,同时析出白色沉淀乙.
则下列离子在原溶液中一定存在的有( )
(1)取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液;
(2)在(1)所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀甲;
(3)在(2)所得溶液中加入过量Ba(OH)2溶液也有气体生成,同时析出白色沉淀乙.
则下列离子在原溶液中一定存在的有( )
| A. | SO42-、AlO2-、Na+ | B. | Na+、CO32-、AlO2- | C. | CO32-、Na+、Al3+ | D. | MnO4-、Na+、CO32- |
17.下列物质一定不属于天然高分子化合物的是( )
| A. | 纤维素 | B. | 蛋白质 | C. | 聚乙烯 | D. | 淀粉 |
4.将硫酸铝、硫酸钾和明矾溶液[KAl(SO4)2•12H2O]等体积等浓度混合.该混合液中SO42-浓度为0.4mol/L.取100mL混合液加入0.4mol/L的KOH溶液,若要产生的沉淀量最大,加入该浓度的KOH的体积是( )
| A. | 100mL | B. | 150mL | C. | 200mL | D. | 250mL |
10.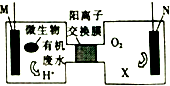 为解决淀粉厂废水中BOD严重超标的问题,有人设计了电化学降解法.如图是利用一种微生物将有机物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,下列说法中正确的是( )
为解决淀粉厂废水中BOD严重超标的问题,有人设计了电化学降解法.如图是利用一种微生物将有机物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,下列说法中正确的是( )
 为解决淀粉厂废水中BOD严重超标的问题,有人设计了电化学降解法.如图是利用一种微生物将有机物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,下列说法中正确的是( )
为解决淀粉厂废水中BOD严重超标的问题,有人设计了电化学降解法.如图是利用一种微生物将有机物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,下列说法中正确的是( )| A. | N极是负极 | |
| B. | 该装置工作时,H+从右侧经阳离子交换膜移向左侧 | |
| C. | 负极的电极反应为:(C6H10O5)n+7H2O-24ne-═6nCO2↑+24nH+ | |
| D. | 物质X是OH- |
11.强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,向1L1mol•L-1的下列溶液中分别加入1L1mol•L-1的NaOH溶液:①稀醋酸;②稀硫酸;③稀盐酸,完全反应的热效应△H1、△H2、△H3的关系正确的是( )
| A. | △H1>△H2>△H3 | B. | △H1<△H3<△H2 | C. | △H1=△H3>△H2 | D. | △H2=△H3<△H1 |
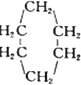 可表示为
可表示为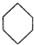 ,下面是某高聚物的合成路线,试完成下列试题:
,下面是某高聚物的合成路线,试完成下列试题: $→_{Ⅰ}^{NH}$
$→_{Ⅰ}^{NH}$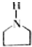 $→_{Ⅱ}^{CH=CH}$A$\stackrel{Ⅲ}{→}$
$→_{Ⅱ}^{CH=CH}$A$\stackrel{Ⅲ}{→}$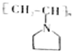
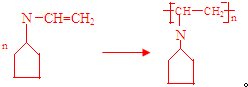 .
.