题目内容
3.将Na2O2分别投入到含有下列离子的溶液中,离子浓度明显减小的是( )①S2- ②SO32- ③HCO3- ④Fe2+ ⑤CO32- ⑥SO42-⑦CH3COO- ⑧NH4+.
| A. | ①②③④⑧ | B. | ①②③④⑤ | C. | ②③④⑤⑧ | D. | ④⑤⑥⑦⑧ |
分析 Na2O2具有强氧化性,与水反应后溶液呈碱性,具有还原性的离子和能与OH-反应的离子浓度减小,据此解答.
解答 解:①S2- 具有还原性,能够被过氧化钠氧化,硫离子浓度减小,故选;
②SO32- 具有还原性,能够被过氧化钠氧化,亚硫酸根离子浓度减小,故选;
③HCO3- 能够与氢氧化钠反应生成碳酸钠,所以碳酸氢根离子浓度减小,故选;
④Fe2+ 具有还原性,能够被过氧化钠氧化,二价铁离子浓度减小,故选;
⑤CO32- 与过氧化钠、氢氧化钠都不反应,离子浓度不变,故不选;
⑥SO42-与过氧化钠、氢氧化钠都不反应,离子浓度不变,故不选;
⑦CH3COO- 与过氧化钠、氢氧化钠都不反应,离子浓度不变,故不选;
⑧NH4+能够与氢氧化钠反应,氨根离子浓度减小,故选;
故选:A.
点评 本题考查了元素化合物知识,明确过氧化钠的性质是解题关键,注意过氧化钠的氧化性和与水反应的产物,题目难度不大.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目
13.在50mL烧杯中加入10mL煤油和10mL水(分层),再将一小块钠投入烧杯.下列关于钠的位置及反应情况,判断正确的是( )
| A. | 钠浮在煤油层上,不反应 | |
| B. | 钠沉在煤油层下,不反应 | |
| C. | 钠沉在煤油层下浮在水层上,在交界处剧烈反应 | |
| D. | 钠沉在水层下剧烈反应 |
14.在容量瓶的使用方法中,下列操作正确的是( )
| A. | 使用容量瓶前检查它是否漏水 | |
| B. | 容量瓶用水洗净后,在干燥箱中 干燥 | |
| C. | 配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线 | |
| D. | 定容后,盖好瓶塞,用食指顶住瓶塞,手握住瓶进颈,左右振荡摇匀 |
11. 25℃时,用浓度为0.1000mol•L-1 的NaOH溶液滴定20mL 浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1 的NaOH溶液滴定20mL 浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
 25℃时,用浓度为0.1000mol•L-1 的NaOH溶液滴定20mL 浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1 的NaOH溶液滴定20mL 浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX | |
| B. | 根据滴定曲线,可得Ka(HY)≈10-6 | |
| C. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) | |
| D. | HY与HZ混合,达到平衡时:c(H+)═c(Y-)+c(Z-)+c(OH-) |
18.若NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,1 L 0.1 mol•L-1 NH4NO3溶液中NH4+、NO3-的数目均为0.1NA | |
| B. | 标准状况下,22.4 L N2和O2的混合气体中含有的原子总数为2NA | |
| C. | 常温常压下,16 g CH4中含有共价键的数目为NA | |
| D. | 16 g CH4与18 g NH4+所含质子数均为10NA |
15. 氨是最重要的化工产品之一.
氨是最重要的化工产品之一.
(1)合成氨工业中,合成塔中每消耗3mol H2,放出92.2kJ热量.
①工业合成氨的热化学方程式是N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol.
②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为18.44;若在同体积的容器中充入2mol N2和6mol H2,达平衡后放出的热量为Q2 kJ,则Q2> 2Q1(填“>”、“<”或“=”)
③已知:1mol N-H键断裂吸收的能量约等于391_kJ.
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行合成氨反应:N2(g)+3H2(g)?2NH3(g)其化学平衡常数K与温度t的关系如下表:
请完成下列问题.
①试比较K1.K2的大小,K1> K2(填写“>”.“=”或“<”).
②下列各项能作为判断该反应达到化学平衡状态的依据是c(填序号字母):
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
③在400℃时,当测得N2、H2和NH3的物质的量分别为2mol、1mol、2mol时,则此时该反应的v(N2)正=v(N2)逆(填写“>”.“=”或“<”)
 氨是最重要的化工产品之一.
氨是最重要的化工产品之一.(1)合成氨工业中,合成塔中每消耗3mol H2,放出92.2kJ热量.
①工业合成氨的热化学方程式是N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol.
②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为18.44;若在同体积的容器中充入2mol N2和6mol H2,达平衡后放出的热量为Q2 kJ,则Q2> 2Q1(填“>”、“<”或“=”)
③已知:1mol N-H键断裂吸收的能量约等于391_kJ.
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行合成氨反应:N2(g)+3H2(g)?2NH3(g)其化学平衡常数K与温度t的关系如下表:
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1.K2的大小,K1> K2(填写“>”.“=”或“<”).
②下列各项能作为判断该反应达到化学平衡状态的依据是c(填序号字母):
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
③在400℃时,当测得N2、H2和NH3的物质的量分别为2mol、1mol、2mol时,则此时该反应的v(N2)正=v(N2)逆(填写“>”.“=”或“<”)
12.下列物质所属类别正确的是( )
| 氧化物 | 酸 | 碱 | 盐 | |
| A | CuO | HCl | NH3•H2O | Na2SO4 |
| B | CO2 | CH3COOH | 火碱 | Cu(OH)2 |
| C | H2O | HBr | 纯碱 | BaSO3 |
| D | MnO2 | HClO | 生石灰 | CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
 +RCl$\stackrel{AlCl_{3}}{→}$
+RCl$\stackrel{AlCl_{3}}{→}$ +HCl(-R为烃基)
+HCl(-R为烃基)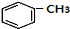 $→_{空气/160-230℃}^{醋酸/锰盐}$
$→_{空气/160-230℃}^{醋酸/锰盐}$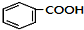
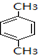 .
. .
.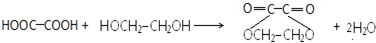 .
.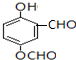 (写出一种即可);
(写出一种即可);