题目内容
10.298K时,用0.1mol/L的盐酸滴定20mL0.1mol/LNH3•H2O溶液,滴定过程中溶液pH变化如图所示.已知:298K时,0.1mol/LNH3•H2O溶液中NH3•H2O的电离度为1%,电离度=$\frac{已电离的电解质分子数}{溶液中原来电解质的总分子数}$×100%,下列有关说法正确的是( )
| A. | a点对应的NH3•H2O溶液的pH=12 | |
| B. | b点混合溶液中:c(C1-)=c(NH4+)+c(NH3•H2O) | |
| C. | c点混合溶液中:c(H+)>[(NH3•H2O)] | |
| D. | d点混合溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
分析 A.根据电离度=$\frac{已电离的电解质分子数}{溶液中原来电解质的总分子数}$×100%及一水合氨按的浓度计算电离出的氢氧根离子浓度,然后可计算出a点对应的NH3•H2O溶液的pH;
B.b点溶质为等浓度的一水合氨和氯化铵,结合物料守恒分析;
C.c点二者恰好反应生成氯化铵,结合氢离子还来自水的电离分析;
D.d点为等浓度的HCl和氯化铵,铵根离子部分水解,则c(H+)>c(NH4+).
解答 解:A.0.1mol/LNH3•H2O溶液中NH3•H2O的电离度为1%,则该氨水中氢氧根离子浓度为:0.1mol/L×1%=0.001mol/L,该溶液的pH=11,故A错误;
B.b点加入10mL等浓度的盐酸,反应后溶质为等浓度的NH3•H2O和氯化铵,根据物料守恒可得:2c(C1-)=c(NH4+)+c(NH3•H2O),故B错误;
C.c点加入20mL等浓度的盐酸,反应后溶质为氯化铵,铵根离子水解生成NH3•H2O和氢离子,氢离子还来自水的电离,则c(H+)>[(NH3•H2O)],故C正确;
D.d点加入40mL盐酸,反应后溶质为等浓度的HCl和NH3•H2O,由于NH4+发生水解,导致其浓度减小,则c(H+)>c(NH4+),溶液中正确的离子浓度大小为:c(Cl-)>c(H+)>c(NH4+)>c(OH-),故D错误;
故选C.
点评 本题考查酸碱混合的定性判断、离子浓度大小比较等知识,题目难度中等,明确曲线各点溶质组成为解答关键,注意掌握溶液酸碱性与溶液pH的关系,能够根据电荷守恒、物料守恒及盐的水解原理判断离子浓度大小.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
1.分子式为C4H10O,属于醇的同分异构体有多少种( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
18.某化学兴趣小组设计实验,测定Na2CO3与NaHCO3混合物中Na2CO3的质量分数.
甲方案:
实验步骤为:①称量空坩埚的质量为A g;②称量装有试样的坩埚质量为B g;③加热;④冷却;⑤称量坩埚和残余物的质量为C g;⑥重复③至⑤操作,直至恒重,质量为D g.
(1)坩埚中发生反应的化学方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
(2)计算Na2CO3质量分数必须用到的测定数据为A、B、D.
乙方案:
在天平上准确称取 0.3000g样品,放入锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用0.1000mol•L-1的标准盐酸滴定至溶液由粉红色刚好变为无色,达到滴定终点时产物为NaHCO3,即HCl+Na2CO3═NaHCO3+NaCl.重复上述操作两次.
(3)配制上述盐酸标准溶液100ml,若用2.0mol/LHCl进行配制,需用量筒量取该HCl溶液5.00ml;定容时俯视刻度线,将导致配制的溶液浓度偏高.(填“偏高”、“偏低”或“没有影响”)
(4)根据表数据,样品中w(Na2CO3)=70.7%.(用百分数表示,保留一位小数)
丙方案:
称取m g样品,选用如图部分装置测定样品与硫酸反应生成的气体体积.

(5)某同学按以下方法检查装置A的气密性:在分液漏斗中加入适量水,如图连接好装置,关闭止水夹a,用止水夹夹住橡皮管c,打开活塞b.若分液漏斗中的水无法持续滴下,试判断装置A是否漏气?无法确定(填“漏气”、“不漏气”或“无法确定”).
实验时,装置A中c的作用平衡气压,有利于液体流出,减小由于液体流下引起的体积误差.
(6)为了提高测定的准确性,应选用装置A和C(填写字母标号)进行实验.
甲方案:
实验步骤为:①称量空坩埚的质量为A g;②称量装有试样的坩埚质量为B g;③加热;④冷却;⑤称量坩埚和残余物的质量为C g;⑥重复③至⑤操作,直至恒重,质量为D g.
(1)坩埚中发生反应的化学方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
(2)计算Na2CO3质量分数必须用到的测定数据为A、B、D.
乙方案:
在天平上准确称取 0.3000g样品,放入锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用0.1000mol•L-1的标准盐酸滴定至溶液由粉红色刚好变为无色,达到滴定终点时产物为NaHCO3,即HCl+Na2CO3═NaHCO3+NaCl.重复上述操作两次.
(3)配制上述盐酸标准溶液100ml,若用2.0mol/LHCl进行配制,需用量筒量取该HCl溶液5.00ml;定容时俯视刻度线,将导致配制的溶液浓度偏高.(填“偏高”、“偏低”或“没有影响”)
(4)根据表数据,样品中w(Na2CO3)=70.7%.(用百分数表示,保留一位小数)
| 滴定次数 | 样品的质量/g | 稀盐酸的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 21.03 |
| 2 | 0.3000 | 2.00 | 21.99 |
| 3 | 0.3000 | 0.20 | 20.20 |
称取m g样品,选用如图部分装置测定样品与硫酸反应生成的气体体积.

(5)某同学按以下方法检查装置A的气密性:在分液漏斗中加入适量水,如图连接好装置,关闭止水夹a,用止水夹夹住橡皮管c,打开活塞b.若分液漏斗中的水无法持续滴下,试判断装置A是否漏气?无法确定(填“漏气”、“不漏气”或“无法确定”).
实验时,装置A中c的作用平衡气压,有利于液体流出,减小由于液体流下引起的体积误差.
(6)为了提高测定的准确性,应选用装置A和C(填写字母标号)进行实验.
15.氮化硼是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质.下列各组物质熔化时所克服的微粒间作用力与氮化硼熔化所克服的微粒间的作用力相同的是( )
| A. | 硝酸钠和金刚石 | B. | 晶体硅和水晶 | C. | 冰和干冰 | D. | 氯化钠和氧化镁 |
2.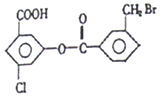 某有机物的结构简式如图:1mol该有机物与足量的氢氧化钠溶液混合并共热,
某有机物的结构简式如图:1mol该有机物与足量的氢氧化钠溶液混合并共热,
充分反应后最多可消耗氢氧化钠的物质的量为( )
 某有机物的结构简式如图:1mol该有机物与足量的氢氧化钠溶液混合并共热,
某有机物的结构简式如图:1mol该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为( )
| A. | 4mol | B. | 5mol | C. | 6mol | D. | 7mol |
19.下列物质属于电解质的是( )
| A. | 氯水 | B. | 葡萄糖 | C. | 水银 | D. | 胆矾 |
14.在①丙烯 ②氯乙烯 ③苯 ④甲苯 ⑤甲醛 四种有机化合物中,分子内所有原子均在同一平面的是( )
| A. | ①②④ | B. | ②③④ | C. | ②③⑤ | D. | ①③⑤ |
