题目内容
往硝酸银、硝酸镁、硝酸铜的混合溶液中加入一定量铁粉,充分反应后,再过滤.下列情况不可能存在的是( )
| A、滤纸上有Ag、Cu,滤液中有Ag+、Fe2+、Mg2+ |
| B、滤纸上有Ag,滤液中有Ag+、Cu2+、Fe2+、Mg2+ |
| C、滤纸上有Ag、Cu,滤液中有Fe2+、Mg2+ |
| D、滤纸上有Ag、Cu、Fe,滤液中有Fe2+、Mg2+ |
考点:铁的化学性质
专题:几种重要的金属及其化合物
分析:氧化性:Ag+>Cu2+>Fe2+>Mg2+,在金属活动性顺序中,Mg>Fe>Cu>Ag,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,AgNO3、Cu(NO3)2、Mg(NO3)2 的混合溶液中加入一些铁粉,Mg>Fe>Cu>Ag,铁不会与硝酸镁反应,故滤液中一定含有硝酸镁,铁与硝酸银反应生成硝酸亚铁和银,铁与硝酸铜反应生成硝酸亚铁和铜,生成的铜与硝酸银能反应生成硝酸铜和银.
解答:
解:A.在硝酸银与硝酸铜同时存在时,Fe先与硝酸银充分反应后再与硝酸铜反应,当滤纸上有Cu时,说明硝酸银全部参加了反应.因此滤液中一定没有硝酸银,即溶液中一定不存在Ag+,故A错误;
B.当铁粉量不足时,只与部分硝酸银反应,生成银,仍有硝酸银剩余,由于氧化性:Ag+>Cu2+>Fe2+>Mg2+,则滤液中有
Ag+、Cu2+、Fe2+、Mg2+,故B正确;
C.当铁粉适量时,能与混合液中的硝酸银和硝酸铜恰好完全反应,生成Ag和Cu,滤液中有Fe2+、Mg2+,故C正确;
D.当铁粉过量时,与混合液中的硝酸银和硝酸铜完全反应,生成Ag和Cu,Fe有剩余,滤液中有Fe2+、Mg2+,故D正确.
故选A.
B.当铁粉量不足时,只与部分硝酸银反应,生成银,仍有硝酸银剩余,由于氧化性:Ag+>Cu2+>Fe2+>Mg2+,则滤液中有
Ag+、Cu2+、Fe2+、Mg2+,故B正确;
C.当铁粉适量时,能与混合液中的硝酸银和硝酸铜恰好完全反应,生成Ag和Cu,滤液中有Fe2+、Mg2+,故C正确;
D.当铁粉过量时,与混合液中的硝酸银和硝酸铜完全反应,生成Ag和Cu,Fe有剩余,滤液中有Fe2+、Mg2+,故D正确.
故选A.
点评:本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序的意义进行,注意离子的氧化性,判断离子反应的先后顺序.

练习册系列答案
相关题目
室温下,下列各组离子在指定溶液中能大量共存的是( )
| A、c(H+)=1.0×10-13mol/L溶液中:C6H5O-、K+、SO42-、Br-- |
| B、饱和氯水中:Cl-、NO3-、Na+、SO32- |
| C、Na2S溶液中:SO42-、K+、Cl-、Cu2+ |
| D、pH=12的溶液中:NO3-、I-、Na+、Al3+ |
下列有关说法正确的是( )
| A、萃取操作可在普通漏斗中完成 |
| B、浓烧碱液沾到皮肤上应立即用稀盐酸冲洗 |
| C、闻未知液体或气体的气味时,应该将试剂瓶口距离口鼻远一些,用手轻轻搧动 |
| D、用容量瓶配制好一定浓度的某溶液后,将溶液保存在容量瓶中并贴上标签 |
下列化学用语或模型图正确的是( )
| A、1-丁醇的结构简式:C4H10O |
B、四氯化碳的电子式: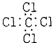 |
C、C2H4的比例模型: |
D、14C的原子结构示意图: |
下列叙述正确的是( )
| A、氧化还原反应的本质是化合价发生变化 |
| B、在化学反应中得电子的物质氧化剂 |
| C、还原剂在反应中发生还原反应 |
| D、失电子越多,还原性越强 |
下列关于Na与Na+性质的叙述中,正确的是( )
| A、它们灼烧时都能使火焰呈现黄色 |
| B、它们的电子层数相同 |
| C、它们都显碱性 |
| D、它们都是强还原剂 |
下列反应的化学方程式书写正确的是( )
| A、碳酸的不稳定H2CO3═CO2+H2O | ||||
B、铝在氧气中燃烧2Al+O2
| ||||
C、乙醇在空气中燃烧C2H5OH+3O2
| ||||
| D、铜与硝酸银溶液反应Cu+AgNO3═CuNO3+Ag |
 (1)常温下,将20.0g 14%的NaCl溶液跟30.0g 24%的NaCl溶液混合,得到密度为1.17g/cm3的混合溶液,该混合溶液中NaCl的物质的量浓度为
(1)常温下,将20.0g 14%的NaCl溶液跟30.0g 24%的NaCl溶液混合,得到密度为1.17g/cm3的混合溶液,该混合溶液中NaCl的物质的量浓度为