题目内容
17.1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,意外地发现生成了一种黄绿色有刺激性气味的气体──氯气.某实验小组设计如图1所示的实验装置.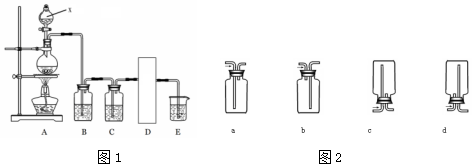
利用图1装置制备纯净、干燥的氯气,并吸收多余氯气防止污染空气.圆底烧瓶内加入二氧化锰,x中加入浓盐酸.
(1)仪器x的名称是分液漏斗,图1D处可以选用图2装置中的a d(填写编号).
(2)圆底烧瓶内发生反应的化学方程式为MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O.
MnCl2+Cl2↑+2H2O.(3)图1装置B中的试剂为饱和食盐水,作用除去氯气中的HCl.
(4)烧杯中发生反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O.
分析 本实验通过装置A制取氯气,涉及的原理是:MnO2+4HCl (浓) MnCl2+Cl2↑+2H2O,由于浓盐酸具有挥发性,制得的氯气不纯,装置B用饱和的食盐水,目的是除去氯化氢得到洁净的氯气,由于氯气表面沾有水分,通过装置C浓硫酸除水,接着通过装置D收集气体,最后用E进行尾气处理,因为氯气有毒.
MnCl2+Cl2↑+2H2O,由于浓盐酸具有挥发性,制得的氯气不纯,装置B用饱和的食盐水,目的是除去氯化氢得到洁净的氯气,由于氯气表面沾有水分,通过装置C浓硫酸除水,接着通过装置D收集气体,最后用E进行尾气处理,因为氯气有毒.
(1)x仪器名称是分液漏斗,所盛放试剂是液体浓盐酸;氯气密度比空气大,用向上排空气法收集;
(2)加热条件下,浓盐酸和二氧化锰发生氧化还原反应生成氯化锰、氯气和水;
(3)因氯气难溶于饱和食盐水,氯化氢极易溶于水,则除去Cl2中的HCl可通过饱和食盐水;
(4)氯气有毒不能直接排放到空气中,用NaOH吸收反应生成NaCl、NaClO和H2O;
解答 解:(1)装置中添加浓盐酸通过分液漏斗,所以x仪器名称是分液漏斗;氯气密度比空气大,应用向上排空气法收集,故选ad,
故答案为:分液漏斗;ad
(2)加热条件下,浓盐酸和二氧化锰反应生成氯化锰、氯气和水,反应方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(3)因浓盐酸具有挥发性,制得的氯气中混有HCl气体,又因氯气难溶于饱和食盐水,则可将气体通过饱和食盐水,以除去HCl,
故答案为:饱和食盐水;除去氯气中的HCl
(4)氯气有毒不能直接排放到空气中,应用NaOH吸收反应生成NaCl、NaClO和H2O,故方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O
点评 本题考查了氯气的制备和性质的检验,熟悉反应原理及氯气的化学性质是解题关键,本题较为简单.

练习册系列答案
相关题目
4.生活中处处有化学,下列说法不正确的是( )
| A. | 铁表面镀锌可增强其抗腐蚀性 | |
| B. | 为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 | |
| C. | “青蒿一握,以水二升渍,绞取汁”,上述对青篙素的提取过程属于物理变化 | |
| D. | 含重金属离子的电镀废液不能随意排放 |
8.下列变化属于化学变化的是( )
| A. | 酒精挥发 | B. | 干冰升华 | C. | 铁钉生锈 | D. | 石蜡融化 |
12.关于铯及其化合物的以下各说法中不正确的是( )
| A. | 氢氧化铯是一种强碱,比KOH的碱性强 | |
| B. | 铯与水或酸溶液反应剧烈,都生成氢气 | |
| C. | Cs的还原性比Na强,故Na+的氧化性大于Cs+ | |
| D. | Al的金属性大于Cs的金属性 |
2.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述不正确的是( )
| A. | 反应速率:前者快,后者慢 | |
| B. | 消耗硝酸的物质的量:前者多,后者少 | |
| C. | 反应生成相同条件下气体的体积:前者多,后者少 | |
| D. | 反应中转移的电子总数:前者多,后者少 |
9.下列各组物质中,不能按图示关系一步完成转化的是( )

| A | B | C | D | |
| a | CO2 | Al(OH)3 | H2SO4 | HNO3 |
| b | Na2CO3 | NaAlO2 | SO2 | NO |
| c | NaHCO3 | Al2O3 | SO3 | NO2 |
| A. | A | B. | B | C. | C | D. | D |
 A、B、C、D、E五种元素的原子序数依次增大.A是原子半价最小的元素;B的最外层电子数是次外层电子数的2倍; D的L能层有两对成对电子;E+的核外有三个能层,且都外于全满状态.试回答下列问题:
A、B、C、D、E五种元素的原子序数依次增大.A是原子半价最小的元素;B的最外层电子数是次外层电子数的2倍; D的L能层有两对成对电子;E+的核外有三个能层,且都外于全满状态.试回答下列问题: