题目内容
 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:(1)用元素符号表示B、C、D三种元素的第一电离能由低到高的顺序
(2)下列说法错误的是
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:C<N<O<F
C.N2与CO为等电子体,化学性质相似
D.由于水分子间存在氢键,所以稳定性:H2O>H2S
(3)E元素的+2价氧化物的熔点比+3价氧化物(高或低),原因是
(4)B单质的一种同素异形体的晶胞如图1所示,若晶体的密度为ρ g/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个原子之间的距离为
(5)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点.
①F原子的外围电子排布式为
②某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图2所示的离子,该离子中碳原子的杂化方式有
考点:晶胞的计算,原子核外电子排布,元素电离能、电负性的含义及应用,原子轨道杂化方式及杂化类型判断
专题:原子组成与结构专题,化学键与晶体结构
分析:A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.A元素能级个数与核外电子数相等,则A为H元素;B元素含有3个能级,且每个能级所含的电子数相同,原子核外电子排布为1s22s22p2,则B为C元素;D的原子核外有8个运动状态不同的电子,则D为O元素;C原子序数介于碳、氧之间,则C为N元素;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,应处于Ⅷ族及相邻的族,E元素的基态原子有4个未成对电子,外围电子排布为3d64s2,则E为Fe,故F为Cu,据此解答.
解答:
解:A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.A元素能级个数与核外电子数相等,则A为H元素;B元素含有3个能级,且每个能级所含的电子数相同,原子核外电子排布为1s22s22p2,则B为C元素;D的原子核外有8个运动状态不同的电子,则D为O元素;C原子序数介于碳、氧之间,则C为N元素;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,应处于Ⅷ族及相邻的族,E元素的基态原子有4个未成对电子,外围电子排布为3d64s2,则E为Fe,故F为Cu,
(1)C、O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能C<O<N,故答案为:C<O<N;
(2)A.沸点:SiO2>CO2,是由于二氧化硅属于原子晶体,二氧化碳形成分子晶体,故A错误;
B.同周期随原子序数增大电负性增大,故电负性顺序:C<N<O,故B正确;
C.N2与CO分子都含有2个原子、价电子总数都是10,二者为等电子体,结构相似,而化学性质相差较大,故C错误;
D.稳定性:H2O>H2S,是因为非金属性O>S,与分子之间存在氢键无关,故D错误,
故答案为:ACD;
(3)Fe2+离子半径比Fe3+离子半径大,所带电荷少,故FeO晶格能比Fe2O3小,FeO的熔点比Fe2O3低,
故答案为:Fe2+离子半径比Fe3+离子半径大,所带电荷少,故FeO晶格能比Fe2O3小;
(4)晶胞中C原子数目=4+6×
+8×
=8,晶胞质量=8×
g=
g,若晶体的密度为ρg/cm3,则
晶胞体积=
=
cm3,则晶胞棱长=
cm,C原子与周围4个C原子形成正四面体,该正四面体的棱长=
cm×
=
×
cm,则晶体中最近的两个原子之间的距离=
cm或
×
;
(5)①F为Cu,原子的外围电子排布式为3d104s1 ,C与A形成的气体N,则A为H元素,N为NH3,F的硫酸盐为CuSO4,向CuSO4溶液中通入过量的NH3可生成[Cu(NH3)4]2+,该离子的结构式为: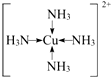 ,
,
故答案为:3d104s1 ; ;
;
②杂环上的碳原子含有3个σ键,没有孤对电子,采用sp2杂化,亚甲基上碳原子含有4个共价单键,采用sp3杂化,故答案为:sp2、sp3.
(1)C、O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能C<O<N,故答案为:C<O<N;
(2)A.沸点:SiO2>CO2,是由于二氧化硅属于原子晶体,二氧化碳形成分子晶体,故A错误;
B.同周期随原子序数增大电负性增大,故电负性顺序:C<N<O,故B正确;
C.N2与CO分子都含有2个原子、价电子总数都是10,二者为等电子体,结构相似,而化学性质相差较大,故C错误;
D.稳定性:H2O>H2S,是因为非金属性O>S,与分子之间存在氢键无关,故D错误,
故答案为:ACD;
(3)Fe2+离子半径比Fe3+离子半径大,所带电荷少,故FeO晶格能比Fe2O3小,FeO的熔点比Fe2O3低,
故答案为:Fe2+离子半径比Fe3+离子半径大,所带电荷少,故FeO晶格能比Fe2O3小;
(4)晶胞中C原子数目=4+6×
| 1 |
| 2 |
| 1 |
| 8 |
| 12 |
| NA |
| 96 |
| NA |
晶胞体积=
| ||
| ρ g/cm3 |
| 96 |
| ρNA |
| 3 |
| ||
| 3 |
| ||
| ||
| 2 |
| 2 |
| 3 |
| ||
| |||||||
2sin
|
| ||
| 4 |
| 3 |
| ||
(5)①F为Cu,原子的外围电子排布式为3d104s1 ,C与A形成的气体N,则A为H元素,N为NH3,F的硫酸盐为CuSO4,向CuSO4溶液中通入过量的NH3可生成[Cu(NH3)4]2+,该离子的结构式为:
 ,
,故答案为:3d104s1 ;
 ;
;②杂环上的碳原子含有3个σ键,没有孤对电子,采用sp2杂化,亚甲基上碳原子含有4个共价单键,采用sp3杂化,故答案为:sp2、sp3.
点评:本题是对物质结构的考查,涉及核外电子排布、电负性、等电子体、晶体类型与性质、配合物、杂化理论、晶胞计算等,注意理解均摊法进行晶胞有关计算,(4)中计算为易错点、难点,需要学生理解晶胞结构,具备一定的空间想象与数学计算能力,注意理解均摊法进行晶胞有关计算,难度中等.

练习册系列答案
相关题目
 将气体甲通入液体乙中得一混合液,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的质量与甲气体在混合液中质量分数关系如图所示,甲、乙组合正确的是( )
将气体甲通入液体乙中得一混合液,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的质量与甲气体在混合液中质量分数关系如图所示,甲、乙组合正确的是( )| A、乙烯 环己烷 |
| B、甲烷 苯 |
| C、乙炔 苯 |
| D、乙烷 乙醇 |
将氯气分别通入含有下列离子的溶液中,其中的离子不发生变化的是( )
| A、SO42- |
| B、Fe2+ |
| C、S2- |
| D、I- |
根据等电子原理,下列分子或离子与SO42-有相似结构的是( )
| A、PCl5 |
| B、CCl4 |
| C、NF3 |
| D、N2 |
 Ⅰ、下列是A、B、C、D、E五种短周期元素的某些性质
Ⅰ、下列是A、B、C、D、E五种短周期元素的某些性质


