题目内容
16.下列有关说法正确的是( )| A. | 用托盘天平准确称取0.4000 g NaCl固体可配成100 mL 0.1000 mol•L-1的NaCl标准溶液 | |
| B. | 有盐桥的原电池和无盐桥的原电池原理相同,因此没必要使用盐桥 | |
| C. | 8NH3(g)+6NO2(g)=7N2(g)+12H2O(g)△H>0,因此该反应不能自发进行 | |
| D. | 电解精炼铜时,阳极泥可用于提取贵重金属 |
分析 A.托盘天平称量到0.1g;
B.没有盐桥的原电池比有盐桥的原电池:效率较低.温度会变.产生的电流较不稳定.如锌铜原电池(没有盐桥的)做例子:正极:铜 负极:锌 电解质:硫酸铜 负极锌棒失去电子形成锌离子,逐渐溶解.在正极铜棒上会有红色物质(铜)析出.但是由于处在同一电解质中,所以有少部分锌会直接与电解质硫酸铜反应,生成的铜单质会附在锌棒表面,这样就会使利用效率降低,而且使产生的电流不稳定;
C.反应自发进行的判断依据是△H-T△S<0;
D.电解精炼铜时,阳极泥中可以回收不如铜活泼的金属.
解答 解:A.托盘天平不能称取0.4000g的NaCl,故A错误;
B.有盐桥使两个半电池构成闭合回路,能使原电池产生较持续稳定的电流,能提高电池的使用效率,保持电中性,使溶液温度不变,没有盐桥的原电池比有盐桥的原电池效率较低,温度会变,产生的电流较不稳定,故B错误;
C.8NH3(g)+6NO2(g)=7N2(g)+12H2O(g)△H>0,气体体积增大△S>0,高温下可以满足△H-T△S<0,因此该反应可能自发进行,故C错误;
D.电解精炼粗铜时,阳极上Zn、Ag失电子生成金属阳离子,Au不易失电子,以固体单质进入溶液形成阳极泥,故D正确;
故选D.
点评 本题考查了托盘天平使用方法、原电池原理的理解应用、反应自发进行的判断依据、电解精炼原理等知识点,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
7.下列方程式表达正确的是( )
| A. | 醋酸钠的水解反应:CH3COO-+H3O+?CH3COOH+H2O | |
| B. | 次氯酸的电离方程式:HClO═H++ClO- | |
| C. | 碳酸的二级电离方程式:HCO3-+H2O?H3O++CO32- | |
| D. | 熔融NaHSO4的电离方程式:NaHSO4=Na++H++SO42- |
1.下列说法均摘自某科普杂志,你认为无科学性错误的是( )
| A. | 铅笔芯的原料是金属铅,儿童在使用时不可用嘴吮咬铅笔,以免引起铅中毒 | |
| B. | 一氧化碳有毒,生有煤炉的居室,可放置数盆清水,这样可有效地吸收一氧化碳,防止煤气中毒 | |
| C. | 为解决能源短缺的问题,使用催化剂将水变成油 | |
| D. | 大气中化学污染物主要是氮氧化物和硫氧化物 |
 ;
; +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O;
+3H2O;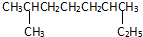 的系统命名是:2,6-二甲基辛烷;
的系统命名是:2,6-二甲基辛烷;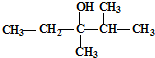 的键线式是
的键线式是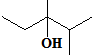 ;
;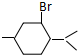 的分子中含有3个手性碳原子;
的分子中含有3个手性碳原子; .
.
