题目内容
4.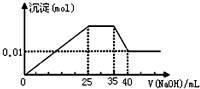 有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-,现取样逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.以下推测错误的是( )
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-,现取样逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.以下推测错误的是( )| A. | 原溶液一定不存在H+、Cu2+、CO32- | |
| B. | 不能确定原溶液是否含有K+、NO3- | |
| C. | 原溶液中n(Mg2+):n(Al3+):n(NH4+)=1:1:2 | |
| D. | 实验所加的NaOH溶液浓度为2mol/L |
分析 无色溶液,不含铜离子,逐滴滴加NaOH 溶液,由图可知,开始加入氢氧化钠溶液就有沉淀生成,说明不含有H+;沉淀最大时,继续滴加氢氧化钠溶液,沉淀部分溶解,推断一定含有Al3+;图象中有一段平台,说明加入OH-时无沉淀生成,有NH4+,NH4++OH-=NH3•H2O,说明含有铵根离子,最后溶液中有沉淀,说明溶液中含Mg2+,镁离子和碳酸根离子不共存,所以溶液中一定不含碳酸根离子,由此分析解答.
解答 解:无色溶液,不含铜离子,逐滴滴加NaOH 溶液,由图可知,开始加入氢氧化钠溶液就有沉淀生成,说明不含有H+;沉淀最大时,继续滴加氢氧化钠溶液,沉淀部分溶解,推断一定含有Al3+;图象中有一段平台,说明加入OH-时无沉淀生成,有NH4+,NH4++OH-=NH3•H2O,说明含有铵根离子,最后溶液中有沉淀,说明溶液中含Mg2+,镁离子和碳酸根离子不共存,所以溶液中一定不含碳酸根离子,
A、原溶液一定不存在H+、Cu2+、CO32-,故A正确;
B、不含碳酸根离子,根据溶液呈电中性,所以一定含硝酸根离子,故B错误;
C、根据图象知,35-40mL时Al(OH)3和NaOH反应生成NaAlO2,则0-25mL时NaOH和Mg2+、Al3+反应生成沉淀,生成NaAlO2时需要NaOH5mL,则生成Al(OH)3需要NaOH 15mL,则有10mLNaOH溶液和镁离子反应,25-35mL时氢氧化钠溶液和NH+4反应生成氨水,根据使用NaOH溶液体积知,n(Mg2+):n(Al3+):n(NH+4)=1:1:2,故C正确;
D、当加入40mLNaOH溶液时,剩余的沉淀是Mg(OH)2,n(Mg(OH)2)=0.01mol,根据原子守恒知,n(Mg2+)=0.01mol,c(Mg2+)=$\frac{0.01mol}{0.1L}$=0.1mol/L,生成0.01molMg(OH)2需要n(NaOH)是0.02mol,Al(OH)3和NaOH反应生成NaAlO2需要NaOH溶液的体积是5mL,则铝离子和NaOH溶液反应生成Al(OH)3沉淀时需要NaOH溶液的体积是15mL,则生成氢氧化镁需要NaOH溶液的体积是10mL,所以c(NaOH)=$\frac{0.02mol}{0.01L}$=2mol/L,故D正确;
故选B.
点评 本题考查了离子共存、离子反应的计算等知识点,定性分析离子共存、定量分析离子的物质的量是解本题的关键,题目难度中等.

| A. | 做焰色反应实验时,应用H2SO4清洗铂丝 | |
| B. | 焰色反应是单质特有的性质 | |
| C. | 碳酸钾在酒精灯上灼烧时能直接观察到紫色火焰 | |
| D. | NaCl与Na2SO4灼烧时火焰颜色均为黄色 |
| A. | 明矾净水 | B. | 钢铁生锈 | C. | 海水提溴 | D. | 工业固氮 |

| A. | 该分子中存在肽键 | |
| B. | 最多可以有12个碳原子共平面 | |
| C. | 1 mol氯雷他定最多可与8 mol氢气发生加成反应 | |
| D. | 能与NaOH溶液反应,但不能与NaHCO3溶液反应 |
3Fe2O3+CO→2Fe3O4+CO2
Fe3O4+CO→3FeO+CO2
FeO+CO→Fe+CO2
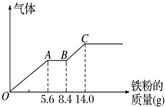
某次实验中,用CO还原4.80g氧化铁,当固体质量变成4.56g时,测得此固体中只存在2种氧化物.则此固体成分和它们的物质的量之比可能的是( )
| A. | n(FeO):n(Fe3O4)=1:1 | B. | n(Fe2O3):n(FeO)=2:1 | ||
| C. | n(Fe2O3):n(FeO)=1:2 | D. | n(Fe2O3):n(Fe3O4)=1:1 |
| A. | TiCl4既是氧化产物又是还原产物 | |
| B. | 氧化剂与还原剂的物质的量之比为1:1 | |
| C. | 当转移电子数目为0.2NA时,气体体积增大1.12L | |
| D. | 当有26g固体参加反应时,转移电子数目为NA. |
 硝酸铜是重要的化工原料,以下三种方法均可得到硝酸铜.
硝酸铜是重要的化工原料,以下三种方法均可得到硝酸铜.