题目内容
实验测得CO、N2和O2等三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为 .若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为 .
考点:物质的量的相关计算
专题:
分析:混合气体的密度是H2的14.5倍,则混合气体平均相对分子质量为29,CO、N2的相对分子质量都是28,可以看作CO、O2的混合气体,令CO、N2的物质的量为xmol、O2的物质的量为ymol,根据平均相对分子质量确定x、y关系,据此计算解答.
解答:
解:混合气体的密度是H2的14.5倍,则混合气体平均相对分子质量为14.5×2=29,CO、N2的相对分子质量都是28,可以看作CO、O2的混合气体,令CO、N2的总物质的量为xmol、O2的物质的量为ymol,则28x+32y=29(x+y),整理得x:y=3:1,
故氧气的质量分数=
×100%=27.6%;
其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为
×100%=48.3%,
故答案为:27.6%;48.3%.
故氧气的质量分数=
| 1mol×32g/mol |
| 1mol×32g/mol+3mol×28g/mol |
其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为
| 1mol×32g/mol+1.5mol×16g/mol |
| 1mol×32g/mol+3mol×28g/mol |
故答案为:27.6%;48.3%.
点评:本题考查混合物计算,侧重对物质的量的有关计算,难度中等,关键是根据相对分子质量将三组分混合物看作两组分混合,注意对基础知识的理解掌握.

练习册系列答案
相关题目
 X、Y、Z、Q均为短周期元素,它们在周期表中相对位置如图所示.若X原子的
X、Y、Z、Q均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍.下列说法中,正确的是( )
| A、X与Q的化合物中含有共价键 |
| B、最高价氧化物对应水化物的酸性:Q比Z弱 |
| C、14X和14Y具有相同的质量数,互为同位素 |
| D、Q与Fe反应生成的化合物中,铁元素显+3价 |
下列性质递变正确的是( )
| A、O、S、Na原子半径依次增大 |
| B、LiOH、NaOH、KOH碱性依次增强 |
| C、HF、NH3、SiH4热稳定性依次增强 |
| D、还原性S2-、Cl-、Na依次增强 |
下列反应,其产物的颜色按红、红褐、淡黄、蓝色顺序排列的是( )
①金属钠在纯氧中燃烧
②Fe2(SO4)3溶液中滴入NaOH溶液
③FeCl3溶液中滴入KSCN溶液
④无水硫酸铜放入医用洒精中.
①金属钠在纯氧中燃烧
②Fe2(SO4)3溶液中滴入NaOH溶液
③FeCl3溶液中滴入KSCN溶液
④无水硫酸铜放入医用洒精中.
| A、②③①④ | B、③②①④ |
| C、③①②④ | D、①②③④ |
二氟一氯甲烷的结构简式( )
| A、有2种 | B、有3种 |
| C、有4种 | D、只有1种 |
下列突发事件处理不当的是( )
| A、室内着火被困,立即用湿毛巾堵住口鼻,匍匐前进,寻找安全出口 |
| B、发现有人煤气中毒,立即关闭阀门,将中毒人员转移到空气清新的地方 |
| C、浓碱溅到皮肤上,立即涂抹稀硫酸 |
| D、误服食品袋中的干燥剂(生石灰),立即喝食醋 |
 aA、bB、cC、dD四种短周期元素,它们的原子序数有如下关系:c-b=b-a=1 且 b+c=d,B的最高价氧化物对应水化物为强酸.
aA、bB、cC、dD四种短周期元素,它们的原子序数有如下关系:c-b=b-a=1 且 b+c=d,B的最高价氧化物对应水化物为强酸.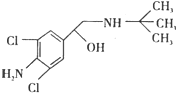 去年,某地区约 300 多人,因食用“瘦肉精”喂养的猪肉而中毒,己知瘦肉精的结构如如图,则它可能发生的化学反应有:①酯化反应 ②取代反应 ③氧化反应 ④消去反应( )
去年,某地区约 300 多人,因食用“瘦肉精”喂养的猪肉而中毒,己知瘦肉精的结构如如图,则它可能发生的化学反应有:①酯化反应 ②取代反应 ③氧化反应 ④消去反应( )