题目内容
2.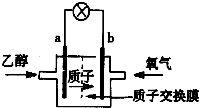 (1)最新研制的一种新型乙醇电池示意图如图,电池的两极分别充入乙醇和氧气,用酸类离子作溶剂.则电池工作时a (选填a或b)为负极,b极的电极反应式为O2+4H++4e-=2H2O
(1)最新研制的一种新型乙醇电池示意图如图,电池的两极分别充入乙醇和氧气,用酸类离子作溶剂.则电池工作时a (选填a或b)为负极,b极的电极反应式为O2+4H++4e-=2H2O(2)欲在某镀件上镀银,将银片和待镀镀件分别做两极,插入加入电镀液(含AgNO3溶液)的大烧杯中.其中待镀的镀件做阴极.接通直流电源后几分钟,就看到镀件的表面镀上了一层银.银电极发生氧化 反应.
(3)铅蓄电池是最常见的二次电池,它由两组栅状极板交替排列而成,极板上分别覆盖有Pb和PbO2,电解质是H2SO4溶液.
①铅蓄电池放电时,其中一个电极的反应如下:PbO2+4H++SO42-+2e-═PbSO4+2H2O
另一个电极的反应为Pb+SO42--2e-═PbSO4
②铅蓄电池充电时,总反应的化学方程式为2PbSO4+2H2O=Pb+PbO2+2H2SO4
③若使用铅蓄电池作电源,用惰性电极电解足量CuCl2溶液.若在阳极上析出气体体积为44.8L(标准状况下),则阴极质量变化128 g,铅蓄电池中参加反应的H2SO4的物质的量为4 mol.
分析 (1)电池的两极分别充入乙醇和氧气,形成原电池反应时,乙醇被氧化,应为负极;b为正极;
(2)电镀时,镀件为阴极,银为阳极;
(3)①反应PbO2+4H++SO42-+2e-═PbSO4+2H2O中,Pb元素化合价降低,被还原,应为原电池的正极反应,负极发生氧化反应;
②电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,充电时发生2PbSO4+2H2O=Pb+PbO2+2H2SO4;
③电解CuCl2溶液,阳极发生2Cl--2e-=Cl2↑,n(Cl2)=2mol,转移4mol电子,由方程式可知Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,消耗4mol硫酸,阴极2mol铜离子变成2molCu;
解答 解:(1)电池的两极分别充入乙醇和氧气,形成原电池反应时,乙醇被氧化,应为负极;b为正极,正极发生O2+4H++4e-=2H2O,故答案为:a;O2+4H++4e-=2H2O;
(2)电镀时,镀件为阴极,银为阳极,被氧化,阴极发生Ag++e-═Ag,故答案为:阴;氧化;
(3)①反应PbO2+4H++SO42-+2e-═PbSO4+2H2O中,Pb元素化合价降低,被还原,应为原电池的正极反应,负极发生氧化反应,电极方程式为Pb+SO42--2e-═PbSO4,故答案为:Pb+SO42--2e-═PbSO4;
②电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,充电时发生2PbSO4+2H2O=Pb+PbO2+2H2SO4,
故答案为:2PbSO4+2H2O=Pb+PbO2+2H2SO4;
③电解CuCl2溶液,阳极发生2Cl--2e-=Cl2↑,n(Cl2)=2mol,转移4mol电子,由方程式可知Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,消耗4mol硫酸,阴极2mol铜离子变成2molCu,所以质量变化为:2×64=128 g,故答案为:128 g;4 mol.
点评 本题考查电解原理,为高频考点,侧重于电极反应、电解产物的计算和判断,题目难度中等,注意把握电解原理,能正确写出电极反应式.

 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案| A. | 乙酸根离子的结构式: | B. | 醛基的电子式: | ||
| C. | 乙酸的结构简式C2H4O2 | D. | 聚乙烯的最简式为CH2 |
| A. | Na2O2 | B. | CO | C. | CaO | D. | SiO2 |
| A. | 不法商贩用甲醛浸泡海鲜可使蛋白质变性 | |
| B. | “人造鸡蛋”与“鸡蛋”的主要成分相同 | |
| C. | 地沟油可转化为生物柴油、航空煤油、重新利用 | |
| D. | 发射神舟十一号载人飞船的燃料偏二甲肼(C2H8N2)属于有机物 |
①Fe、FeCl3
②C、CO2
③AlCl3、NaAlO2
④NaOH、NaHCO3
⑤S、SO3
⑥Na2CO3、CO2.
| A. | ②③④⑥ | B. | ②③④⑤⑥ | C. | ①②③④⑥ | D. | ①②③④⑤⑥ |
| 实验目的 | 实验操作 | |
| A | 除去蛋白质中混有的(NH4)2SO4 | 将混合物装入半透明袋,并放入流动的蒸馏水中 |
| B | 除去Mg粉中混有Al粉 | 加入足量NaOH溶液,过滤、洗涤、干燥 |
| C | 用苯萃取溴水中的Br2 | 先从分液漏斗下口放出水层,再从上口倒出有机层 |
| D | 测定NaClO溶液中的pH | 用玻璃棒蘸取溶液点滴在pH试纸上,与标准比色卡对照 |
| A. | A | B. | B | C. | C | D. | D |
| A. | HF的电子式: | |
| B. | S2-结构示意图: | |
| C. | 异丁烷的结构简式:CH3CH2CH2CH3 | |
| D. | 硝酸钙的电离方程式:Ca(NO3)2=Ca2++(NO3)22- |
 .
.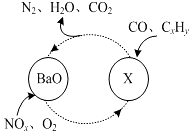 近几年来关于氮污染的治理备受关注.
近几年来关于氮污染的治理备受关注. .
.