题目内容
14. 近几年来关于氮污染的治理备受关注.
近几年来关于氮污染的治理备受关注.(1)混合氧化物LAGM是一种催化效果优异的汽车尾气三效催化剂,其组成为LaAlGeMn0.3O2.4.氧元素位于周期表中第二周期VIA族.Ge(锗)与碳同主族,与钾同周期,则Ge的原子结构示意图为
 .
.(2)三效催化剂能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图所示,
①在图示的转化中,X的化学式为Ba(NO3)2.
②SCR技术可使NOx与NH3的直接反应,实现无害转化.当NO与NO2的物质的量之比为4:1时与NH3发生反应的化学方程式:8NH3+8NO+2NO2$\frac{\underline{\;催化剂\;}}{\;}$9N2+12H2O.
(3)过量次氯酸钠可使废水中NH4+ 完全转化为N2,若处理废水产生了0.112L N2(标准状况),则需消耗0.25mol•L-1的次氯酸钠的体积为60mL.
分析 (1)氧元素为8号元素,位于周期表中第二周期,第VIA;Ge(锗)与碳同主族,所以最外层4个电子与钾同周期,所以是四个电子层,根据化合价代数和为0分析解答;
(2)①由X+CO+CxHy→BaO+N2+H2O+CO2可知,碳元素的化合价升高,所以必有另一种元素的化合降低,只能是氮元素,由此分析解答;
②NO与NO2的物质的量之比为4:1时与NH3发生反应生成氮气,设一氧化氮的物质的量为4mol,所以二氧化氮的物质的量为1mol,则两种气体共得电子的物质的量为:2×4+4=12mol,所以氨气的物质的量为3mol,根据得失电子守恒,反应为:4NO+NO2+4NH3=$\frac{9}{2}$N2+6H2O;
(3)根据反应的离子方程式进行计算.
解答 解:(1)氧元素为8号元素,位于周期表中第二周期,第VIA族;Ge(锗)与碳同主族,所以最外层4个电子与钾同周期,所以是四个电子层,所以Ge的原子结构示意图为 ,故答案为:二;VIA;
,故答案为:二;VIA; ;
;
(2)①(2)由X+CO+CxHy→BaO+N2+H2O+CO2可知,碳元素的化合价升高,所以必有另一种元素的化合降低,只能是氮元素,根据质量守恒,X中必有钡元素,所以X是Ba(NO3)2,故答案为:Ba(NO3)2;
②NO与NO2的物质的量之比为4:1时与NH3发生反应生成氮气,设一氧化氮的物质的量为4mol,所以二氧化氮的物质的量为1mol,则两种气体共得电子的物质的量为:2×4+4=12mol,所以氨气的物质的量为3mol,根据得失电子守恒,反应为:4NO+NO2+4NH3=$\frac{9}{2}$N2+6H2O,所以化学方程式为:8NH3+8NO+2NO2$\frac{\underline{\;催化剂\;}}{\;}$9N2+12H2O,故答案为:8NH3+8NO+2NO2$\frac{\underline{\;催化剂\;}}{\;}$9N2+12H2O;
(3)由2NH4++3ClO-=N2↑+3Cl-+2H++3H2O得,处理废水产生了0.112L 即$\frac{0.112L}{22.4L/mol}$=0.005mol N2(标准状况),则需消耗浓度为0.25mol•L-1的次氯酸钠的体积为$\frac{0.005mol×3}{0.25mol•{L}^{-1}}$×1000ml=60ml,
故答案为:60.
点评 本题重点考查了氧化还原反应,注意把握氧化还原反应的本质是解决本题的关键,难度中等,注意化合价降低为氧化剂被还原,化合价升高为还原剂被氧化.

 某有机物结构简式如图所示.下列说法不正确的是 ( )
某有机物结构简式如图所示.下列说法不正确的是 ( )| A. | 该有机物的分子式为C26H20 | |
| B. | 该有机物不能使溴水褪色 | |
| C. | 该有机物的一氯代物有3种 | |
| D. | 该有机物既可发生加成反应,又可发生取代反应 |
| A. | 过量的铁粉在氯气中燃烧:Fe+Cl2$\frac{\underline{\;点燃\;}}{\;}$FeCl2 | |
| B. | 金属钠在空气中燃烧:4Na+O2$\frac{\underline{\;点燃\;}}{\;}$2Na2O | |
| C. | 高炉炼铁中,还原铁矿石:2Fe2O3+3C$\frac{\underline{\;高温\;}}{\;}$4Fe+3CO2 | |
| D. | 金属镁着火,不能用CO2灭火:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C |
| A. | 高锰酸钾在常用危险化学品分类中属于第4类易燃固体 | |
| B. | 浓氢氧化钠溅到皮肤上,立即用大量水冲洗,再涂上稀硼酸溶液 | |
| C. | 做蒸发结晶实验时,用坩埚钳夹持热蒸发皿直接放于实验台面上 | |
| D. | 做分液操作时,待液体分层将上层液体从上口倒出后,下层液体从下口放出 |
①加入AgNO3溶液;
②加入NaOH水溶液;
③加热;
④加入蒸馏水
⑤加稀硝酸至酸性;
⑥加入NaOH醇溶液.
| A. | ⑥③⑤① | B. | ①②③⑤ | C. | ④⑥③① | D. | ④③①⑤ |
| A. | 胶体区别于其它分散系的本质特征是分散质的微粒直径在1nm~100nm | |
| B. | Fe(OH)3胶体带正电 | |
| C. | 往Fe(OH)3胶体中逐滴滴入硫酸溶液,现象是:先有红褐色沉淀后沉淀溶解 | |
| D. | Fe(OH)3胶体能够吸附水中悬浮的固体颗粒沉降,达到净水目的 |
| A. | 用洁净的铂丝蘸取某溶液,置于火焰上灼烧,透过蓝色钴玻璃能观察到火焰呈紫色,则该溶液中一定含有钾离子 | |
| B. | 向某溶液中滴加足量稀盐酸,产生的气体能使澄清石灰水变浑浊,则说明原溶液中一定含CO32- | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 如果在蒸馏实验中忘记加沸石,可以先停止加热,待溶液冷却后补加沸石,再继续加热蒸馏 |
| A. | 维生素C能促进人体对铁的吸收,利用了维生素C的氧化性 | |
| B. | 食品中大量添加苯甲酸钠灯防腐剂,可有效延长其保质期 | |
| C. | 《本草经集注》中记载了区别硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”,这是运用了焰色反应 | |
| D. | “从沙滩到用户”,计算机芯片的材料是指单质铁 |
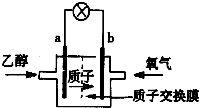 (1)最新研制的一种新型乙醇电池示意图如图,电池的两极分别充入乙醇和氧气,用酸类离子作溶剂.则电池工作时a (选填a或b)为负极,b极的电极反应式为O2+4H++4e-=2H2O
(1)最新研制的一种新型乙醇电池示意图如图,电池的两极分别充入乙醇和氧气,用酸类离子作溶剂.则电池工作时a (选填a或b)为负极,b极的电极反应式为O2+4H++4e-=2H2O