题目内容
13.为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3).碘酸钾和碘化钾在溶液中能发生反应:KIO3+5KI+3H2SO4═3I2+3K2SO4+3H2O①该反应中,氧化剂是KIO3,氧化产物是I2;
②氧化性:KIO3 >I2(填“>”、“<”或“=”);
③当有3mol I2生成时,转移电子的物质的量为5mol.
分析 ①该反应中I元素化合价由+5价、-1价变为0价,得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,氧化剂对应的产物是还原产物,还原剂对应的产物是氧化产物;
②同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;
③当有3mol I2生成时,生成碘的$\frac{1}{6}$来自于碘酸钾.
解答 解:①该反应中I元素化合价由+5价、-1价变为0价,得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,氧化剂对应的产物是还原产物,还原剂对应的产物是氧化产物,所以KIO3是氧化剂、KI是还原剂,还原产物和氧化产物都是I2,故答案为:KIO3;I2;
②同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,氧化剂是碘酸钾、氧化产物的碘,所以氧化性:KIO3 >I2,故答案为:>;
③当有3mol I2生成时,生成碘的$\frac{1}{6}$来自于碘酸钾,所以转移电子物质的量=3mol×2×$\frac{1}{6}$×(5-0)=5mol,
故答案为:5.
点评 本题考查氧化还原反应有关计算及基本概念,明确元素化合价变化与氧化剂、还原剂关系是解本题关键,注意该反应中氧化产物和还原产物是同一种物质,知道氧化性强弱比较方法.

练习册系列答案
 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
4.在FeCl2溶液加入过量Na2O2固体,充分搅拌(此时烧杯中液体呈浑浊状)后再加入过量盐酸使固体全部溶解,此时烧杯中阳离主要有( )
| A. | 只有Fe2+ | B. | Na+、Fe3+ | ||
| C. | Na+、Fe3+ 和H+ | D. | H+、Na+、Fe3+ 和Fe2+ |
5.下列说法不正确的是①将盛有二氧化氮气体的试管倒立在水中,溶液充满试管 ②酒精灯加热铝箔至熔化,铝并不滴落,说明铝表面生成了一层致密的氧化膜 ③向蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性( )
| A. | ①② | B. | ②③ | C. | ①③ | D. | ①②③ |
2.下列说法不正确的是( )
| A. | 为除去FeSO4溶液中的Fe2(SO4)3,可加入铁粉,再过滤 | |
| B. | 除去乙醇中的水:加入生石灰,蒸馏 | |
| C. | 为除去乙炔气中少量的H2S,可使其通过CuSO4溶液 | |
| D. | 为除去CO2中少量的SO2,可使其通过饱和Na2CO3溶液 |
3.下列离子方程式正确的是( )
| A. | 碳酸钙和盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 向氢氧化钡溶液中加硫酸溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 向稀盐酸溶液中加铁:3Fe+6H+═3Fe3++3H2↑ | |
| D. | 向硝酸银溶液中加盐酸:Ag++Cl-═AgCl↓ |

 .
. (1)根据要求填空:
(1)根据要求填空: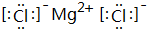
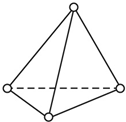
 在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.
在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子. ; A2D由液态形成晶体时密度减小(填增大,不变或减小),分析主要原因(用文字叙述)水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小
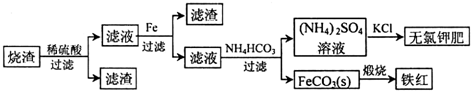
; A2D由液态形成晶体时密度减小(填增大,不变或减小),分析主要原因(用文字叙述)水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小 硫化亚铁是一种黑色块状固体,常温下难溶于水,易溶于酸而生成能溶于水的硫化氢气体.硫化亚铁在空气中煅烧时生成二氧化硫气体和烧渣.
硫化亚铁是一种黑色块状固体,常温下难溶于水,易溶于酸而生成能溶于水的硫化氢气体.硫化亚铁在空气中煅烧时生成二氧化硫气体和烧渣.