题目内容
6.为了防止枪支生锈,常用化学处理使钢铁零件表面生成Fe3O4的致密保护层-“发蓝”.化学处理过程中其中一步的反应为:3Fe+NaNO2+5NaOH═3Na2FeO2+H2O+NH3↑.下列叙述不正确的是( )| A. | 枪支“发蓝”实质上是使铁表面钝化 | |
| B. | 上述反应中,铁被氧化 | |
| C. | NO2-的氧化性大于FeO22-的氧化性 | |
| D. | 反应中转移电子2mol,生成还原产物8.5g |
分析 该化学反应中,Fe元素的化合价从0变为+2价,化合价升高了2价,则Fe为还原剂;N元素从NaNO2中的+3价变为NH3中的-3价,化合价降低了6价;氨气为还原产物,反应中生成1mol氨气转移6mol电子;该反应中氧化剂为NO2-,氧化产物为FeO22-,则NO2-的氧化性大于FeO22-的氧化性,据此进行解答.
解答 解:A.枪支“发蓝”是一层致密保护层Fe3O4,其实质上是使铁表面钝化,故A正确;
B.该反应中Fe的化合价从0价变为+2价,Fe的化合价升高被氧化,故B正确;
C.反应中氧化剂为NO2-,氧化产物为FeO22-,氧化剂的氧化性大于氧化产物,则NO2-的氧化性大于FeO22-的氧化性,故C正确;
D.氨气为还原产物,N元素从NaNO2中的+3价变为NH3中的-3价,化合价降低了6价,生成1mol氨气转移6mol电子,则转移2mol电子生成氨气的物质的量为:$\frac{2mol}{6}$=$\frac{1}{3}$mol,生成氨气的质量为:17g/mol×$\frac{1}{3}$mol=6.7g,故D错误;
故选D.
点评 本题考查氧化还原反应的计算与判断,题目难度中等,明确氧化还原反应中化合价变化为解答关键,从化合价的角度分析氧化还原反应,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.胶体的特性是( )
| A. | 有丁达尔现象 | B. | 加热会聚沉 | C. | 电泳 | D. | 胶状 |
17.试剂瓶上贴有 标志的物质是( )
标志的物质是( )
 标志的物质是( )
标志的物质是( )| A. | 浓硫酸 | B. | NaCl溶液 | C. | NH4Cl溶液 | D. | Na2SO4溶液 |
14.下列过程中没有发生化学变化的是( )
| A. | 用漂白粉给游泳池的水消毒 | B. | 袋装食品装人硅胶防潮 | ||
| C. | 用小苏打烹制面包 | D. | 袋装食品装人铁粉作抗氧化剂 |
1.配制0.1000mol/LH2SO4溶液250mL,下列有关说法错误的是( )
| A. | 在配制过程中玻璃棒的作用是搅拌和引流 | |
| B. | 用到的仪器有250 mL容量瓶、托盘天平、量筒、烧杯、玻璃棒和胶头滴管 | |
| C. | 浓硫酸在烧杯中稀释后,立即转移到容量瓶进行后续操作,所配溶液浓度偏高 | |
| D. | 液面离容量瓶刻度线1~2cm时,应改用胶头滴管滴加水 |
11.下列物质中,属于电解质的是( )
| A. | 硝酸钾 | B. | 盐酸 | C. | 酒精 | D. | 铜 |
18.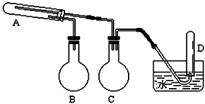 在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去).根据图示判断下列说法不正确的是( )
在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去).根据图示判断下列说法不正确的是( )
 在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去).根据图示判断下列说法不正确的是( )
在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去).根据图示判断下列说法不正确的是( )| A. | 实验进行时试管A中应加入的试剂是普通铁粉 | |
| B. | 烧瓶B的作用是防止倒吸,烧瓶C的作用是产生水蒸气 | |
| C. | 试管D中收集得到的是H2 | |
| D. | 3 mol单质Fe全部转变为Fe3O4,失去8 mol电子 |
15.为了防止患甲状腺肿大病,市售的食盐中常添加一定量的( )
| A. | 葡萄糖 | B. | 碘酸钾 | C. | 碳酸钠 | D. | 氯化钾 |
16.下列实验方法不正确的是( )
| A. | 用BaCl2溶液鉴别硫酸铵和氯化铵两种固体 | |
| B. | 用尝味道的方法鉴别蔗糖溶液和硫酸溶液 | |
| C. | 用稀盐酸鉴别碳酸钾和硝酸钾两种固体 | |
| D. | 用灼烧闻气味的方法鉴别丝绸和棉布 |