题目内容
已知CO和C的燃烧热分别是110.5kJ?mol-1、393.5kJ?mol-1.则 3.6g碳在6.4g氧气中燃烧至反应物耗尽时比3.6g碳在氧气中完全燃烧时少放出的热量是( )
| A、47.8kJ |
| B、22.1 kJ |
| C、56.2kJ |
| D、18.5kJ |
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:燃烧热是指1mol可燃物完全燃烧释放的热量,碳在氧气中燃烧,氧气不足发生反应2C+O2
2CO,氧气足量发生反应C+O2
CO2.3.6g碳的物质的量为0.3mol,6.4g的氧气的物质的量为0.2mol,n(C):n(O2)=3:2,介于2:1与1:1之间,所以上述反应都发生令生成的CO为xmol,CO2为ymol,根据碳元素与氧元素守恒列方程计算x、y的值,计算CO生成二氧化碳放出的热量为3.6g碳在氧气中完全燃烧时少放出的热量.
| ||
| ||
解答:
解:碳在氧气中燃烧,氧气不足发生反应2C+O2
2CO,氧气足量发生反应C+O2
CO2,3.6g碳的物质的量为
=0.3mol,6.4g的氧气的物质的量为
=0.2mol,n(C):n(O2)=3:2,介于2:1与1:1之间,所以上述反应都发生,令生成的CO为xmol,CO2为ymol,根据碳元素守恒有x+y=0.3,根据氧元素守恒有x+2y=0.2×2,联立方程
,解得
,
燃烧热是指1mol可燃物完全燃烧释放的热量,C和CO的燃烧热分别是393.5kJ?mol-1、110.5kJ?mol-1,0.2molCO完全燃烧放出热量为3.6g碳在6.4g氧气中燃烧至反应物耗尽时比3.6g碳在氧气中完全燃烧时少放出的热量:0.2mol×110.5kJ?mol-1=22.1kJ,
故选B.
| ||
| ||
| 3.6g |
| 12g/mol |
| 6.4g |
| 32g/mol |
|
|
燃烧热是指1mol可燃物完全燃烧释放的热量,C和CO的燃烧热分别是393.5kJ?mol-1、110.5kJ?mol-1,0.2molCO完全燃烧放出热量为3.6g碳在6.4g氧气中燃烧至反应物耗尽时比3.6g碳在氧气中完全燃烧时少放出的热量:0.2mol×110.5kJ?mol-1=22.1kJ,
故选B.
点评:本题主要考查了有关燃烧热概念的理解应用计算,题目难度不大,注意物质的量与热量成正比,判断碳与氧气反应产物中一氧化碳与二氧化碳的物质的量是解题的关键.

练习册系列答案
相关题目
已建立化学平衡的可逆反应,改变条件使平衡向正反应方向移动,下列叙述中正确的是( )
| A、生成物的浓度一定增大 |
| B、生成物的百分含量一定增大 |
| C、反应物的浓度一定降低 |
| D、正反应速率一定大于逆反应速率 |
下列各组离子在指定条件下一定不能大量共存的是( )
| A、能使红色石蕊试纸变蓝的溶液中:Na+、K+、CO32-、NO3-、AlO2- |
| B、c(H+)=0.lmol?L-1的溶液中:Cu2+、A13+、SO42-、NO3- |
| C、在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- |
| D、在含有大量 Fe3+的溶液中:NH4+、Na+、Cl-、SO42- |
下列溶液中Cl-浓度最小的是( )
| A、200ml 3mol/L MgCl2溶液 |
| B、1000ml 4mol/L NaCl溶液 |
| C、300ml 5mol/L KCL溶液 |
| D、1000ml 1mol/L AlCl3溶液 |
关于硝酸的说法正确的是( )
| A、硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2 |
| B、常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
| C、硝酸与金属反应时,主要是+5价的氮得电子 |
| D、浓HNO3与浓HCl按3:1的体积比所得的混合物叫王水 |
下列与含氯化合物有关的说法正确的是( )
| A、随着化合价的升高,氯的含氧酸酸性和氧化性均逐渐增强 |
| B、向漂白粉中加入浓盐酸能产生黄绿色气体 |
| C、熔融氯化铝不导电,氯化铝溶液能导电,所以氯化铝是离子化合物 |
| D、检验Cl2中是否混有HCl,可以用湿润的淀粉-KI试纸 |
下列关于平衡常数K的说法中,正确的是( )
①平衡常数K只与反应本身及温度有关
②改变反应物浓度或生成物浓度都会改变平衡常数K
③加入催化剂不改变平衡常数K
④平衡常数K只与温度有关,与反应的本身及浓度、压强无关.
①平衡常数K只与反应本身及温度有关
②改变反应物浓度或生成物浓度都会改变平衡常数K
③加入催化剂不改变平衡常数K
④平衡常数K只与温度有关,与反应的本身及浓度、压强无关.
| A、①② | B、②③ | C、③④ | D、①③ |
下列物质中属于非电解质的是( )
| A、盐酸 |
| B、氨水 |
| C、H2SO4 |
| D、SO3 |
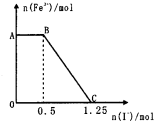 已知酸性高锰酸钾溶液可以将FeS04氧化,方程式为2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,则下列有关说法不正确的是( )
已知酸性高锰酸钾溶液可以将FeS04氧化,方程式为2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,则下列有关说法不正确的是( )| A、图中AB段主要是高锰酸钾和碘化钾溶液反应 |
| B、图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 |
| C、向C点以后的溶液中加入少量KSCN溶液,溶液变红色 |
| D、根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25mol |