题目内容
一定温度和一定体积的密闭容器中发生如下反应:A2(s)+B2(g)?2AB(g),反应达到平衡状态的标志是( )
| A、V正(B2)═2V逆(AB) |
| B、单位时间内生成2molAB的同时消耗1mol的B2 |
| C、容器内的总压强不随时间而变化 |
| D、气体密度不再随时间变化而变化 |
考点:化学平衡状态的判断
专题:
分析:化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量不变,注意化学方程式的特点是反应前后气体体积改变的反应.
解答:
解:A、化学反应速率之比等于化学计量数之比,当2V正(B2)═V逆(AB)时,说明正逆反应速率相等,反应达到平衡状态,故A错误;
B、生成2molAB的同时消耗1mol的B2,都是正反应速率,无法证明正逆反应速率相等,故B错误;
C、反应前后气体体积不相等,所以压强不变说明各组分浓度不变,反应达到平衡状态,故C正确;
D、容器体积不变,A为固态,所以密度不变说明反应达到平衡状态,故D正确;
故选CD.
B、生成2molAB的同时消耗1mol的B2,都是正反应速率,无法证明正逆反应速率相等,故B错误;
C、反应前后气体体积不相等,所以压强不变说明各组分浓度不变,反应达到平衡状态,故C正确;
D、容器体积不变,A为固态,所以密度不变说明反应达到平衡状态,故D正确;
故选CD.
点评:本题利用一些基本量来判断一个可逆反应是否达到化学平衡状态,判断时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列变化需克服相同类型作用力的是( )
| A、碘和干冰的升华 |
| B、硅和C60的熔化 |
| C、氯化氢和氯化钾的溶解 |
| D、溴气化和冰融化 |
下列说法中,正确的是( )
| A、NH3是碱性气体,能使酚酞溶液变红色 |
| B、SiO2是酸性氧化物,不溶于任何酸 |
| C、SO2具有漂白性,能使溴水褪色 |
| D、浓H2SO4具有吸水性,能使蔗糖发生炭化 |
将a g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如图的实线所示,在相同的条件下,将b g(a>b)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是( )
A、 |
B、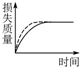 |
C、 |
D、 |
航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为2NH4ClO4═N2↑+4H2O+Cl2↑+2O2↑+热量,对此反应下列叙述中错误的是( )
| A、上述反应属于分解反应 |
| B、上述反应瞬间产生大量高温气体推动航天飞机飞行 |
| C、从能量变化来说,主要是化学能转变为动能和热能 |
| D、反应中高氯酸铵只作氧化剂 |
1mol甲烷完全和氯气发生取代反应,生成四种取代产物的 物质的量相同,那么消耗氯气的物质的量为( )
| A、0.5mol |
| B、2mol |
| C、2.5mol |
| D、4mol |
