题目内容
【题目】有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器略去).实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内.在玻璃反应管内装入适量水(使钠块不与水接触).实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内.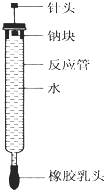
(1)钠与水反应的离子方程式为 .
(2)实验中“钠块熔化为闪亮的小球”说明;向烧杯中的溶液中滴加 , 溶液变红,说明钠与水反应生成碱性物质.
(3)如果实验前加入反应管内水的体积为a mL,欲使水最终全部被排出,则所取金属钠的质量至少为g.(设当时实验条件下气体摩尔体积为V mL/mol,写出简要步骤)
【答案】
(1)2Na+2H2O=2Na++2OH﹣+H2↑
(2)钠的熔点低,反应放热;酚酞溶液
(3)![]()
【解析】解:(1)钠与水反应生成氢氧化钠和氢气,反应的化学方程式为:2Na+2H2O=2Na++2OH﹣+H2↑;故答案为:2Na+2H2O=2Na++2OH﹣+H2↑;(2)钠块熔化为闪亮的小球,说明钠的熔点低,反应放热;钠与水反应生成氢氧化钠,溶液呈碱性,滴加酚酞溶液变红;故答案为:钠的熔点低,反应放热;酚酞溶液;(3)实验前加入反应管内水的体积为a mL,欲使水最终全部被排出,即氢气的体积为a mL,其物质的量为 ![]() =
= ![]() mol,
mol,
由2Na+2H2O=2NaOH+H2↑
2 1
n(Na) ![]() mol
mol
n(Na)= ![]() mol×2=
mol×2= ![]() mol,质量为m(Na)=
mol,质量为m(Na)= ![]() mol×23g/mol=
mol×23g/mol= ![]() g;
g;
故答案为: ![]() ;
;
(1)钠与水反应生成氢氧化钠和氢气;(2)钠块熔化为闪亮的小球,说明钠的熔点低,反应放热;钠与水反应生成氢氧化钠,溶液呈碱性;(3)根据实验前加入反应管内水的体积为a mL,欲使水最终全部被排出,即氢气的体积为a mL,利用化学方程式2Na+2H2O=2NaOH+H2↑;

【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: 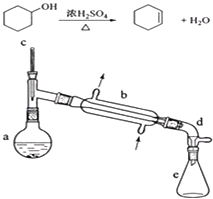
可能用到的有关数据如下:
相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置a的名称是 .
(2)加入碎瓷片的作用是;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并;在本实验分离过程中,产物应该从分液漏斗的(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是 .
(5)在环己烯粗产物蒸馏过程中,可能用到的仪器有(填正确答案标号).
A圆底烧瓶 B温度计 C漏斗 D玻璃棒 E接收器
(6)本实验中最容易产生的副产物的结构简式为 .