题目内容
【题目】研究碳和硫的化合物的性质,有助于合理控制温室效应、环境污染,并能进行资源化利用,还可重新获得燃料或重要工业产品.
(1)有科学家提出可利用FeO吸收和利用CO2 , 相关热化学方程式如下: 6FeO(s)+CO2(g)═2Fe3O4(s)+C(s)△H=﹣76.0kJmol﹣1
①上述反应的还原产物为 , 每生成1mol Fe3O4 , 转移电子的物质的量为mol;
②已知:C(s)+2H2O(g)═CO2(g)+2H2(g)△H=+113.4kJmol﹣1 , 则反应:
3FeO(s)+H2O(g)═Fe3O4(s)+H2(g)的△H= .
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g)CH4(g)+2H2O(g).向一容积为2L的恒容密闭容器中充入一定量的CO2和H2 , 在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2molL﹣1 , H2 0.8molL﹣1 , CH4 0.8molL﹣1 , H2O 1.6molL﹣1 . 则300℃时上述反应的平衡常数K= . 200℃时该反应的平衡常数K=64.8,则该反应的△H(填“>”或“<”)0.
【答案】
(1)C;2;+18.7kJ/mol
(2)25;<
【解析】解:(1)①反应6FeO(s)+CO2(g)═2Fe3O4(s)+C(s)中,Fe元素化合价由+2价部分升高到+3价,C元素化合价由+4价降低到0价,还原产物为C,每生成1mol Fe3O4 , 则生成0.5molC,转移2mol电子, 所以答案是:C;2;
②6FeO(s)+CO2(g)=2Fe3O4(s)+C(s)△H=﹣76.0kJmol﹣1
C(s)+2H2O(g)=CO2(g)+2H2(g)△H=+113.4kJmol﹣1 ,
两热化学方程式相加除以2得:3FeO(s)+H2O(g)=Fe3O4(s)+H2(g)
△H=(﹣76.0kJ/mol+113.4kJ/mol)÷2=+18.7kJ/mol,
所以答案是:+18.7kJ/mol;(2)平衡状态c(H2)=c(CH4)=0.8mol/L,c(CO2)=0.2mol/L;
CO2(g) | + | 4H2(g) | CH4(g) | + | 2H2O(g) | ||
起始量(mol/L) | 1.0 | 4.0 | 0 | 0 | |||
变化量(mol/L) | 0.8 | 3.2 | 0.8 | 1.6 | |||
平衡量(mol/L) | 0.2 | 0.8 | 0.8 | 1.6 |
反应的平衡常数表达式K= ![]() =
= ![]() =25,因为200℃时该反应的平衡常数K=64.8,所以升温K变小,平衡向逆反应方向移动,所以△H<0;
=25,因为200℃时该反应的平衡常数K=64.8,所以升温K变小,平衡向逆反应方向移动,所以△H<0;
所以答案是:25;<.
【考点精析】根据题目的已知条件,利用反应热和焓变和化学平衡的计算的相关知识可以得到问题的答案,需要掌握在化学反应中放出或吸收的热量,通常叫反应热;反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

 名校课堂系列答案
名校课堂系列答案【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: 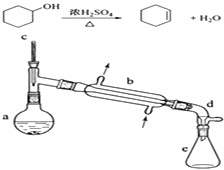
可能用到的有关数据如下:
相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置a的名称是 .
(2)加入碎瓷片的作用是;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并;在本实验分离过程中,产物应该从分液漏斗的(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是 .
(5)在环己烯粗产物蒸馏过程中,可能用到的仪器有 ABE (填正确答案标号).
A圆底烧瓶 B温度计 C漏斗 D玻璃棒 E接收器
(6)本实验所得到的环己烯产率是 . (保留两位有效数字)
(注:产率= ![]() ×100%)
×100%)
【题目】下列是有关某种淀粉酶的实验,处理方式及结果如表及图所示.根据结果判断,叙述正确的是 ( )
试管编号 | 试管Ⅰ | 试管Ⅱ | 试管Ⅲ |
pH | 8 | 8 | 7 |
温度 | 60℃ | 40℃ | 40℃ |
淀粉酶 | 1mL | 1mL | 1mL |
淀粉 | 1mL | 1mL | 1mL |

A.甲物质是淀粉酶抑制剂
B.此种淀粉酶在作用35min后便会失去活性
C.此种淀粉酶在中性环境中的作用速率比在碱性中的快
D.此种淀粉酶较适合在40℃的环境下起作用