题目内容
下列叙述正确的是
A.在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
C
【解析】
试题分析:A.原电池的负极发生失电子的氧化反应,在电解池的阴极上发生得电子的还原反应,错误;B.用惰性电极电解Na2SO4溶液,阴极生成氢气,阳极生成氧气,两极产物的物质的量之比为2:1,错误;C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH,正确;D.镀层破损后,镀锡铁板,铁比锡活泼做负极,腐蚀加快,镀锌铁板锌比铁活泼,铁做正极,受到保护,错误;选C。
考点:考查原电池、电解池的工作原理,金属的腐蚀与防护。

练习册系列答案
相关题目

 2SO3(g)经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为
2SO3(g)经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为

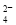 +Ba2++OH-
+Ba2++OH- BaSO4↓+H2O
BaSO4↓+H2O